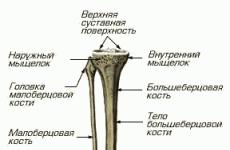
Причинами ренальной опн являются. Острая и хроническая почечная недостаточность. Профилактика почечной недостаточности

Как установить точный диагноз?
Для того чтобы с точностью определить диагноз патологии, необходимо провести ряд лабораторных и инструментальных исследований. При острой почечной недостаточности диагностика определяет повышенный уровень калия и азотистых веществ в крови. Такое повышение наблюдается из-за осложнения оттока мочи. Это является главным маркером для определения ОПН.
Не менее важным лабораторными исследованиями являются:
- анализ крови (показывает понижение гемоглобина, повышение скорости оседания эритроцитов и уровня лейкоцитов), при проведении биохимии обнаруживается избыток креатина, мочевины и калия, пониженный уровень кальция и натрия;
- анализ мочи (в результате окажется понижение уровня тромбоцитов, повышение лейкоцитов и эритроцитов, падение плотности , наличие белка и цилиндров), при суточном анализе мочи проявляется понижение диуреза.
К инструментальным исследованиям относятся:
- электрокардиограмма (используется для контроля работы сердца);
- ультразвуковое исследование (оценивает размер почек, обструкцию и уровень кровоснабжения);
- биопсия почек;
- рентгенография легких и миокарда.

С помощью вышеперечисленных методов диагностики устанавливается точный диагноз ОПН у взрослых. Установив этиологический фактор, форму и стадию заболевания, врач назначает соответствующую терапию.
Лечение ОПН и неотложная помощь
Лечение острой почечной недостаточности начинается с оказания больному скорой доврачебной помощи. Для этого необходимо в кратчайшие сроки доставить больного в отделение стационара. Во время перевозки или ожидания квалифицированного медика, больному необходимо обеспечить полный покой, укутать пациента в теплый плед, и уложить в горизонтальное положение.
При острой почечной недостаточности лечение определяется стадией патологического состояния и его этиологическим фактором.
Первым терапевтическим приемом является устранение причины ОПН: выведение больного из шокового состояния, восстановление кровоснабжения и пассажа мочи при обструкции мочеточников, проведение детоксикации при отравлении и т. п.
Для устранения этиологических факторов используются следующие препараты:
- антибиотики при инфекционных заболеваниях;
- мочегонные средства для увеличения оттока крови и предотвращения или устранения периферических отеков;
- сердечные препараты при нарушениях работы миокарда;
- растворы солей для восстановления электролитного баланса;
- гипотензивные средства для понижения артериального давления.

А также для устранения первопричины проводится ряд терапевтических методов, среди которых промывание желудка при интоксикации организма и оперативное вмешательство для восстановления травмированных тканей почек или для удаления факторов, препятствующих оттоку мочи. При гемодинамических нарушениях выполняется переливание кровезаменителей, а при развитии анемии переливают эритроцитарную массу.
После устранения первопричины проводится консервативная медикаментозная терапия. А также обеспечивается полный контроль за клиническими показателями больного. Больному нужно каждый день проводить сбор анамнеза и физикальное исследование, замер массы тела, измерение поступаемых и выделяемых веществ, осмотр ран и мест внутривенного вливания.
Больному корректируется рацион. В меню диеты должно быть низкое содержание белка (20–25 г./сутки) и соли (до 2–4 г./сутки). Из рациона полностью исключаются продукты с повышенным содержанием калия, магния и фосфора. Калорийность питания обеспечивается жирами и углеводами и должна составлять 4–50 ккал/кг.

Если у больного наблюдается значительный избыток мочевины до 24 ммоль/л и калия до 7 ммоль/л, а также выраженные симптомы уремии , ацидоза и гипергидратации, это является прямым показанием к проведению гемодиализа. На сегодняшний день проведения гемодиализа обусловлено даже в целях профилактики , для предотвращения возникновения возможных осложнений, связанных с нарушением метаболизма.
Почечная недостаточность острого характера течения является тяжелым патологическим состоянием, при котором нарушается работа почек. Вследствие таких сбоев в функционировании, нарушается метаболизм, отток мочи, возникает дисбаланс кислотно-щелочного и водно-электролитного равновесия. Патология имеет обширный ряд осложненных состояний, среди которых аритмия, отек легких и головного мозга, гидроторакс и другие патологии, которые наносят весомый ущерб организму. Для купирования заболевания больного необходимо в обязательном порядке поместить в отделение стационара. Не следует заниматься самолечением, так как неадекватное применение лекарственных средств может привести к переходу патологии с острой формы в хроническую.
Сбой функционирования двух почек, спровоцированное ослаблением кровоснабжения, задержка гломерулярной фильтрации называется острой почечной недостаточностью (ОПН).
Итогом становится абсолютная остановка вывода токсинов, сбой кислотно-основного, электролитного, водного равновесия. Грамотная терапия предотвращает болезненные процессы.
Острая почечная недостаточность — это сбой функционирования двух почек
По врачебной статистике недуг поражает 200 человек из 1 миллиона.
Особенности почечной недостаточности
Острая почечная недостаточность – сокращения, остановки работы почек, провоцирующая увеличение метаболитов азотистого обмена, сбой метаболизма. Патологии работы нефрона обусловлено сокращением кровоснабжения, сокращением кислорода.

Патология ОПН для возникновения требует от пары часов до недели, длится более суток. Ранее посещение доктора обеспечивает абсолютное возобновление работы пораженного органа. ОПН становится обострением болезненных патологий, подразделяется на формы:
- Гемодинамическая (перенеральная), вызванная резким сбоем гемодинамики. Характеризуется уменьшением кровоснабжения, падением темпа гломерулярной фильтрации. Сбои подобного типа обусловлены сокращением количества пульсирующей крови. Если не происходит восстановления кровоснабжения, то вероятны отмирания почечных тканей.
- Паренхиматозная (ренальная) – возникает из-за токсического или ишемического влияния на паренхиму почки или острого воспаления. В итоге осуществляется повреждение целостности канальцев, выброс их внутренностей в ткани.
- Обструктивная (постренальная) – формируется после образовавшейся непроходимости мочевыводящих каналов. Этот тип предусматривает сохранение функций, мочевыделение будет затруднено.
По уровню сохранности диуреза разделяют неолигурическую, олигурическую форму.
Причины острой почечной недостаточности
Этиологию недуга различают по форме. К факторам образования преренальной ОПН относятся:
- сокращение сердечного выброса;
- закупорка легочной артерии;
- хирургические вмешательства, травмирование с потерей крови;
- повреждение тканей высокими температурами;
- потеря большого воды и солей, обусловленное жидким стулом, рвотой;
- прием диуретических средств;
- падение тонуса сосудов.
Предпосылки для ренальной формы ОПН:
- токсичное влияние на почечные ткани ядовитых растений, медных, ртутных солей;
- неконтролируемый использование лекарств (антибластомные препараты, противомикробные средства и сульфаниламиды);
- средства контрастирования, лекарства способны вызвать патологию у людей;
- повышенный уровень миоглобина при продолжительном сдавливании тканей во время травмирования, наркотической, алкогольной коме;
- почечные заболевания воспалительного характера.

Существует масса причин для развития заболевания
Факторами развития постренальной ОПН выступают:
- патологии сердечного аппарата;
- сбои ритма сердцебиения;
- тампонада сердца, дегидратация;
- поражение тканей организма высокими температурами;
- асцит, пониженное АД;
- закупоривание сосудов, несущих кровь к почкам;
- отравляющее влияние ядовитых веществ;
- наличие воспалительных патологий.
При травмировании и обширного оперирования образование ОПН обусловливают: шок, заражение или гемотрансфузия, терапия с нефротоксичными медикаментами.
Симптомы острой почечной недостаточности
Отличительные черты характеризуются развитием. Отмечается усугубление самочувствия больного, сбой функционирования органов. Симптоматику проявления ОПН делят на типы по стадиям.
Начальная стадия сопровождается периферической отечностью, увеличением веса. Первичная фаза не обнаруживается из-за отсутствия признаков. Циркуляторный кризис, появляющийся на стадии, обладает длительностью, протекает незаметно. Неспецифичные признаки почечной недостаточности (мышечное бессилие, тошнота, головная боль) маскируются симптоматикой фонового недуга – шока, травмирования либо отравления.

Начальная стадия сопровождается увеличением веса
Если предпосылкой к ОПН выступил острый гломерулонефрит, наблюдаются кровяные сгустки в моче, боли в спине. Начальная фаза ОПН сопровождается пониженным АД, бледным цветом кожи, ускоренным сердцебиением, сокращением диуреза.
Тяжелой стадией считается олигоанурия. Она дает угрозу для жизни пациента, сопровождается признаками:
- сокращение либо остановка отделения урины;
- отравление метаболитами азотистого обмена, выражающееся в форме тошноты, рвоты, утраты аппетита;
- рост АД;
- сложности в концентрации, обмороки;
- коматозное состояние;
- отечность соединительной ткани и внутренних органов;
- увеличение веса от переизбытка жидкости в организме.
Последующий ход ОПН обусловливается результативностью лечения на второй фазе. Положительный результат обеспечивает наступление особого этапа. Прослеживается рост диуреза, образуется полиурия. Из организма устраняется жидкость, сокращается отечность, будет очищение крови от токсинов.

Фаза полиурии несет опасность дегидратацией, сбоем электролитного равновесия. Спустя месяц происходит нормализация диуреза, появляется стадия выздоровления, которая продолжается до 12 месяцев.
При неэффективной терапии, образуется терминальная фаза ОПН с риском смертности. Проявляется в виде признаков:
- затрудненное дыхание, кашель в легких;
- отхождение мокроты с кровяными капельками;
- обмороки, кома;
- спазмирование, судороги;
- критические сбои в сердцебиении.
Заболевание поражает организм, провоцирует развитие атрофии сердечного мускула, перикардита, энцефалопатии, ослабление иммунитета.
Диагностика почечной недостаточности
Процесс диагностирования включает действия доктора:
- изучение анамнеза патологии, жалоб пациента;
- исследование жизненного анамнеза (подвергались ли органы травмированию, были ли у больного отравления, потери крови, наличие хронических почечных недугов, сахарного диабета), сопряженность рабочих или жизненных условий с регулярной интоксикацией (лакокрасочные вещества, растворители);
- проводится полная оценка общего состояния пациента (степень сознания, окрас кожной поверхности, показатели АД), изучение системы мочевыделения при помощи пальпации (ощупывание), легкое постукивание ребром ладони в поясничном отделе (может сопровождаться болью в пораженной стороне);
- исследования крови: присутствие малокровия (сокращение степени гемоглобина и числа эритроцитов, из-за выработки почками гормона, обеспечивающего производство эритроцитов), рост продуктов белкового распада – креатинина, мочевины;
- исследование урины – снижение объема ее выработки, возникновение протеина в моче, рост мочевины, креатинина (устраняют почки);
- изучение электролитов, мочевых составляющих для вероятных почечных патологий;
- ультразвуковое исследование почек;
- обследование мочевика, уретры оптическим оборудованием;
- радионуклидные способы – позволяют визуализировать функциональное, анатомическое строение органов, определить тип повреждения тканей или мочевыделительного аппарата, воспалительные черты, присутствие конкрементов либо опухоли;
- по показаниям (в случае затянувшегося хода ОПН или ее неизвестной этиологии – выполняется биопсия почки).

Диагностику заболевания проводит врач
Не лишней будет информация о размере органа. Уменьшение размера сообщает о присутствии хронической недостаточности.
Неотложная помощь при заболевании
При синдроме ОПН неотложная помощь предполагает вызов скорой помощи либо быстрое транспортирование больного в стационар медицинского учреждения, потом пациенту необходимо обеспечить:
- постельный режим;
- согревание тела;
- выведение из гиповолемии и шокового состояния (тахикардии, гипотонии, затрудненного дыхания, синюшности кожи, слизистых тканей, анурии, дегидратации);
- струйное введение теплого солевого раствора «Трисоль»;
- активная терапия сепсиса;
- внутривенные капельные инъекции Допамина обеспечивает улучшение кровообращения. Внутривенно вводится Гепарин, проводится его капельное введение.

Лечение лучше всего проводить в стационаре
Возобновление работы почек происходит во время компенсации внутрисосудистого объема жидкости, терапии заражения крови, остановке приема нефротоксичных лекарств.
Лечение острой почечной недостаточности
На первом этапе заболевания терапия предусматривает устранение фактора, который спровоцировал ОПН. При наличии шока требуется компенсировать объем циркулирующей крови, наладить показатели АД.
Использование урологами инновационных способов, как экстракорпоральная гемокоррекция обеспечивает очистку организма от ядов, вызвавших образование ОПН. Помогают гемосорбция, плазмаферез. В случае присутствия обструктивных признаков восстанавливается обычный пассаж мочи. Для этого удаляются конкременты из почек, мочеточников.

Процедура гемосорбции
Олигурическая фаза сопровождается назначениями фуросемида, осмотических диуретиков, стимулирующих диурез. Устанавливая размер вводимой жидкости, исключая потери при мочеиспускании, рвоте, дефекации кишечника, нужно принимать во внимание потоотделение, дыхание.
Пациенту назначается белковое питание, ограничивают попадание калия с едой. Производится осушение ран, устранение зон, пораженных некрозом. Дозировка антибиотиков основывается на тяжести поражения почек.
Возможные осложнения заболевания
Инициирующая и поддерживающая стадии ОПН сопровождаются сбоями в выводе продуктов азотного обмена, воды, электролитов и кислот. Проявленность изменений в химической структуре крови, обусловлено олигурией, процессом катаболизма у пациента.
Отмечается степень клубочковой фильтрации по сравнению с пациентами без олигурии. У первых с уриной выделяется больше азотного обмена, воды, электролитов.
Сбои при ОПН без олигурии у пациентов проявляются слабее, чем у пациентов, пораженных патологией.
Нормальный рост концентрации калия в кровяной сыворотке у пациентов без олигурии и катаболизма — это 0,3 — 0,5 ммоль/сут. Крупные объемы свидетельствуют о калиевой нагрузке эндогенного или экзогенного типа, а также о высвобождении калия из клеток по причине ацидемии.

Заболевание может давать осложнения
Тяжелые последствия патологии могут включать уремию, как самостоятельную интоксикацию организма продуктами белкового метаболизма. Происходит сбой в функционировании органов и систем:
- гиперкалиемии, провоцирующей изменения на ЭКГ, в результате будет остановка сердца. Патология влияет на развитие мышечной слабости и тетрапареза;
- изменений крови – подавление кроветворной функции, производства эритроцитов. Уменьшается длительность существования эритроцитов, начинает развитие анемия;
- подавления иммунной системы, что обусловливает появление болезней инфекционного типа, добавление инфекции усугубляет ход заболевания и часто приводит к летальному исходу;
- проявления сбоев неврологического характера – слабость, помрачнение сознания, чувство дезориентации, медлительность, сменяющаяся этапами возбуждения;
- патологий со стороны сердечно-сосудистого аппарата – аритмия, перикардит, артериальная гипертония;
- сбоев работы ЖКТ – неприятные ощущения в области брюшины, тошнота, отсутствие аппетита. В острых ситуациях вероятно развитие уремического гастроэнтероколита;
- последним этапом развития уремии выступает уремическая кома – пациент погружается в бессознательное состояние, образуются тяжелые сбои функционирования дыхательного и сердечно–сосудистого аппарата.
Грамотно проводимая терапия обеспечивает полную обратимость заболевания, кроме его самых тяжелых случаев. Исход болезни зависит от возраста пациента, уровня нарушения работы почек, присутствия осложнений.
У определенной доли пациентов функции почек восстанавливаются целиком, 1-3% нуждаются в гемодиализе.
Острая почечная недостаточность (ОПН) - неспецифический, полиэтиологичный синдром, который возникает вследствие острой транзиторной или необратимой утраты гомеостатических функций почек, обусловленной гипоксией почечной ткани с последующим преимущественным повреждением канальцев и отеком интерстициальной ткани.
Синдром ОПН проявляется нарастающей азотемией, электролитным дисбалансом, декомпенсированным метаболическим ацидозом и нарушением способности к выделению воды. Тяжесть клинической картины ОПН определяется соотношением между степенями вовлечения в патологический процесс канальцев, интерстициальной ткани и клубочков.
Частота ОПН варьируется в широких пределах в зависимости от возраста и региона. В развивающихся странах ОПН у детей очень часто наблюдается в связи с инфекционной диареей и уменьшением объема жидкости в организме. В США и Западной Европе у 5% всех госпитализированных больных отмечается ОПН, но у детей ее частота ниже, за исключением периода новорожденности. У новорожденных детей, поступающих в отделения интенсивной терапии, ее частота достигает 6%.
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ И КЛАССИФИКАЦИЯ. ОПН является следствием различных заболеваний. Общепринято подразделение ОПН в зависимости от происхождения, анатомической локализации первичного повреждения и основных патогенетических механизмов на преренальные, ренальные и постренальные формы.
Некоторые исследователи преренальную форму ОПН называют еще функциональной, ренальную - органической (или структурной), а постренальную - обтурационной.
В течении ОПН традиционно выделяют 4 стадии: начальную (преданурическую), олигоанурическую, полиурическую и восстановительную. За исключением первой, для каждой из них характерна достаточно четкая клинико-лабораторная симптоматика.
Преренальная форма ОПН обусловлена причинами, которые вызывают дегидратацию, острую гиповолемию, артериальную гипотензию и гемодинамические расстройства, как правило, вследствие компенсаторной централизации кровообращения с резким нарушением почечного кровотока (рис. 86).
В частности, ОПН при гиповолемии может быть вследствие кровотечения, дегидратации и большой потери электролитов, при различных видах шока (травматического, инфекционного, постгеморрагического), острой дегидратации при ожогах, истощающих диареях, реже - при неукротимой рвоте и передозировке диуретиков, а также вследствие массивных отеков при нефротическом синдроме.
Преренальная ОПН возникает также в результате артериальной гипотензии вследствие уменьшения сердечного оттока при сердечной недостаточности и периферической вазодилатации.
В основе патогенеза преренальной ОПН лежит устойчивое и значительное снижение почечного кровотока и уменьшение гидростатического давления в капиллярах клубочков почек.
Основные причинные факторы преренальной ОПН, такие как гипотензия, уменьшение объема жидкости в организме, генерализованный отек, обуславливают абсолютное или относительное уменьшение эффективного объема артериальной крови, что приводит к уменьшению перфузии жизненно важных органов и падению среднего артериального давления. В результате этого активируются как центральные, так и периферические барорецепторы, запускающие компенсаторные механизмы: повышение сократимости сердечной мышцы и спазм венозных и артериальных сосудов. Это способствует кратковременному улучшению перфузии жизненно важных органов и поддержанию артериального давления.
Однако при этом выделяется большое количество вазоактивных веществ, таких как ренин, ангиотензин II, простагландин Е2, которые способствуют спазму артериол, прежде всего - сосудистого русла почек. Это приводит к снижению почечного кровотока и уменьшению гидростатического давления в капиллярах клубочков почек. В результате наступает значительное уменьшение скорости клубочковой фильтрации и к повышению уровня азота мочевины и креатинина сыворотки крови.
Таким образом, в основе преренальной ОПН лежит уменьшение почечного кровотока вследствие внепочечных нарушений. Поэтому она характеризуется снижением клубочковой фильтрации без патоморфологических изменений самого клубочка. Функция канальцев сохранена. Поэтому, с одной стороны, наблюдается уменьшение диуреза, а с другой - продукция концентрированной, насыщенной мочевиной и креатинином мочи с низким содержанием натрия. Важно также то, что при устранении причины заболевания преренальная ОПН претерпевает быстрое обратное развитие.
Постренальная форма ОПН. Может возникнуть при наличии причин, затрудняющих отток мочи: камни, закупорка кристаллами сульфаниламидов и мочевой кислоты, сгустками крови, опухолевой тканью, а также инфравезикальная обструкция при клапанах шейки мочевого пузыря.
Из постренальных причин следует также выделить острую уратную нефропатию на фоне применения интенсивной химиотерапии при диссеминированных злокачественных заболеваниях, острой лейкемии и лимфомах. Такое осложнение следует предвидеть и, по возможности, предотвращать с помощью аллопуринола и инфузионных программ терапии.
В генезе острой олигурии на фоне обструктивной уропатии важная роль принадлежит нарушению уродинамики, повышению внутрилоханочного и внутриканальцевого давления. Возрастающее внутриканальцевое давление передается на капилляры клубочка и приводит к уменьшению клубочковой фильтрации. Вторичный пиелонефрит усугубляет функциональные расстройства и может быть причиной декомпенсации.
После устранения препятствия на пути оттока мочи состояние быстро нормализуется.
Ренальная форма ОПН. Характеризуется повреждениями структуры почек различной этиологии, но при этом полного восстановления почечной паренхимы не происходит. Выделяют 3 группы причин ренальной ОПН, возникающей вследствие (рис. 87):
Поражения клубочков и паренхимы почек;
Повреждения почечных канальцев и интерстициальной ткани;
Поражения почечных сосудов.
В основе патогенеза решльной ОПН лежит острый некроз канальцев почек, который является неспецифической реакцией на различные повреждающие факторы, включая ишемию, эндогенные и экзогенные токсины и другие нарушения.
Патогенез ренальной формы ОПН можно представить, хотя и довольно схематично, следующим образом (рис. 88).


Причины возникновения и прогрессирования ренальной ОПН патогенетически можно разделить на 3 группы: преимущественное нарушение почечной гемодинамики, внутрисосудистая блокада почечного кровотока, первичные тубулоинтерстициальные повреждения.
Кроме того, ишемия почек и токсины играют определенную роль как в нарушении внутрипочечной гемодинамики, так и в тубулоинтерстициальных изменениях в почках.
В результате воздействия указанных факторов снижается почечный кровоток с шунтированием крови на уровне кортикомедуллярной зоны сосудов, ишемизацией и гипоксией кортикального слоя почек. Чрезмерное поступление крови в мозговой слой сопровождается замедлением кровотока. Прямые сосуды переполняются не только вследствие шунтирования крови, но и из-за нарушения ее реологических свойств (сладж-синдром). Это изменяет отток крови из юкстамедуллярных клубочков.
Снижение кровотока в корковом слое и переполнение кровью мозгового вещества в значительной степени усиливают гипоксию нефрона, а также отек интерстиция.
Описанные изменения, наряду с расстройством дренажной функции лимфатической системы почки и отеком интерстициальной ткани, нарушают как образование, так и продвижение мочи к собирательным трубочкам, следствием чего является развитие анурии.
Спазм сосудов коркового вещества почек приводит к кортикальному некрозу, при котором может повреждаться от 20 до 100% клеток коры почек. Предполагают также, что неполная блокада капилляров и артериол фибрином повреждает эритроциты механически. В почках появляются кровоизлияния различной выраженности и локализации. Геморрагиям соответствует системное поражение эндотелия капилляров. В почках определяется сегментарный некроз коркового слоя. В сосудистых петлях многих клубочков, а также в просвете приводящих артериол имеются тромбы. Некротизированные петли клубочковых капилляров подвергаются лизису и представлены клеточно-тканевым детритом. В капсуле клубочков также нередко обнаруживают ШИК-позитивные вещества и фибрин. Эпителий проксимального отдела извитых канальцев, как правило, в одних местах частично некротизирован и слущен, в других - лишь сохранен на базальной мембране.
В дальнейшем морфологической основой нарушений являются два типа повреждений канальцев: тубулонекроз - сохранение базальной мембраны при некрозе канальцевого эпителия; тубулорексис - очаговое повреждение канальцев, где кроме некроза эпителия местами разрушена и базальная мембрана. Замечено, что при острой токсической нефропатии чаще наблюдается тубулонекроз, в то время как при «шоковой почке» преобладают более глубокие изменения нефрона с выраженным тубулорексисом.
Микроскопически капилляры клубочков чаще не изменены; характерных изменений клеток эндотелия, мезангия и базальных мембран не наблюдается.
У разных больных повреждения канальцев разной степени располагаются на отдельных участках мозгового вещества, но более заметны на границе коркового и мозгового вещества почек. Проксимальные сегменты прямого канальца наиболее чувствительны к ишемии и токсическому действию тяжелых металлов, а проксимальные сегменты извитого канальца - к токсическому эффекту аминогликозидов.
Столь глубокие патологические изменения почек влекут за собой тяжелые нарушения почечных функций с последующей анурией. Для ее поддержания имеют значение устойчивый спазм почечных сосудов, закупорка канальцев, обратное всасывание фильтрата, уменьшение проницаемости капилляров клубочков, высокое интерстициальное давление в почке.
Считают, что значительное снижение скорости клубочковой фильтрации, наблюдаемое при О П Н, вызвано увеличением сопротивления в почечных сегментах, которое происходит благодаря спазму афферентных артериол, и в результате канальцевой обструкции. Канальцы при данной патологии значительно расширены, и в некоторых нефронах обнаружены остатки распавшихся клеток, накопления цилиндров, содержащих слущенные некротизированные остатки клеток.
Следовательно, первичное повреждение эпителия канальцев и обратное всасывание фильтрата являются наиболее важным патогенетическим фактором, играющим роль в возникновении олигурии при О П Н. Фильтрация может быть в норме или умеренно сниженной, но из-за повреждений канальцев фильтрат реабсорбируется через высокопроницаемый канальцевый эпителий.
Механизмы повреждения клеток нефрона связаны с молекулярными изменениями на уровне клеточных мембран и цитоплазмы. Они представлены взаимосвязанными процессами, обусловленными клеточным энергетическим дефицитом с недостатком макроэргических соединений, нарушением энергозависимых калий-натриевого и натрий-кальциевого насосов, накоплением ионов калия в цитоплазме и митохондриях, активацией внутриклеточных фосфолипаз и протеаз, разобщением окислительного фосфорилирования, накоплением свободных кислородных радикалов и перекисным окислением липидов. Финал этого процесса - мембранолиз и аутолиз клетки. Изучение этих процессов при О П Н и их предотвращение и лечение в настоящее время еще не вышли за пределы эксперимента. Можно предполагать, что исход ОПН тесно связан с нарушениями клеточного метаболизма и путями его коррекции. Об этом свидетельствуют положительные результаты использования при ОПН блокаторов кальциевых каналов.
ПАТОГЕНЕЗ ПОЛИУРИЧЕСКОЙ И ВОССТАНОВИТЕЛЬНОЙ СТАДИЙ. Существуют, по крайней мере, три возможных объяснения возникновения полиурической стадии острой почечной недостаточности.
Во-первых, гемодинамическая функция наибольшего числа нефронов может быть полностью сохранена после первичного воздействия, в то время как реабсорбционная способность этих нефронов значительно повреждена.
Во-вторых, относительно меньшее снижение фильтрации по сравнению с угнетением реабсорбционной способности всех нефронов также приводит к полиурии.
В-третьих, полиурия в определенных случаях может явиться результатом изменения интерстициальной ткани мозгового слоя почек, которым определяется величина выведения воды из нисходящего колена петли нефрона. Изменения нормального кортикально-медуллярного осмотического градиента увеличивают фракционную подачу профильтрованной воды в участке за изгибом петли нефрона. Даже со снижением скорости фильтрации это приводит к увеличению фракционной или абсолютной экскреции воды.
У большинства больных морфологически в почках в полиурической стадии отмечается довольно быстрая динамика. Благодаря фибринолитическим процессам исчезают интракапиллярные глыбки фибрина и фибриноподобных субстанций, стабилизируется проницаемость капилляров клубочков, полностью исчезает почечная вазоконстрикция, снижается отек интерстиция, рассасываются инфильтраты, слущивается и отторгается некротизированный эпителий. Уже в течение 1-й недели полиурической стадии регенерирует эпителий вдоль нетронутой основной мембраны, вплоть до восстановления целостности канальца. В местах тубулорексиса сравнительно быстро пролиферирующие элементы интерстиция заполняют дефект нефрона, который подвергается рубцовой деформации.
Полиурическая стадия переходит в восстановительную, длительность которой определяется остаточной массой действующих нефронов. В редких наблюдениях процесс улучшения сопровождается прогрессирующей атрофией паренхимы, что клинически проявляется в хронизации процесса и последующем переходе в ХПН.
Таким образом, О П Н может быть вызвана различными состояниями, включая те, которые возникают вследствие прямого гемодинамического или нефротоксического воздействия. В патогенезе О П Н целесообразно выделять отдельную фазу начального действия этиологического фактора и фазу утраты почечных функций. В первой из них почечная ишемия и/или прямой эффект нефротоксических агентов обусловливают почечные повреждения. Во второй декомпенсацию почечных функций поддерживает ряд факторов:
Устойчивый спазм приносящих почечных артериол;
Закупорка канальцев, поступление ультрафильтрата через поврежденный эпителий канальцев;
Снижение проницаемости капилляров клубочков.
Патогенез О П Н сложен и до настоящего времени во многом еще окончательно не разрешен, однако все формы ее объединяет обязательный фактор ишемии почек с трофическими, а в тяжелых случаях - дегенеративными поражениями нефрона. У детей О П Н является серьезным клиническим синдромом, но, поскольку патологические изменения в большинстве случаев ограничиваются дистрофическими изменениями различной степени, консервативные и экстракорпоральные методы детоксикации настолько эффективны, что в современной клинической картине ОПН большинством авторов трактуется как обратимое состояние.
Относительная частота различных этиологических факторов зависит от возрастной группы, к которой принадлежит больной. Точных данных об относительной частоте разных форм ОПН нет, но, по сводным данным, распределение причинных факторов ОПН можно представить в следующем виде (табл. 106).

Помимо этиологического подхода к классификации олигурий, целесообразно сниженный диурез подразделять в зависимости от того, какую фазу собственно ОПН он сопровождает.
В развитии ОПН можно выделить две фазы:
Начальную, или фазу острой олигурий (функциональную почечную недостаточность, преданурическую стадию ОПН), при которой ишемия, токсины, обструктивная уропатия запускают механизмы, приводящие к повреждению нефрона, преимущественно его канальцевого аппарата;
Фазу органических повреждений нефрона, когда олигоанурия поддерживается анатомическими изменениями.
Эта периодизация позволяет разработать комплекс лечебно-тактических мероприятий, при которых в первой фазе необходимо предупреждать повреждение нефрона и во второй - обеспечить поддерживающую терапию, дающую возможность ребенку дожить до начальных репаративных процессов в почке.
КЛИНИЧЕСКАЯ КАРТИНА. ОПН развивается как осложнение острых заболеваний, при которых создаются условия для функциональных или органических нарушений функции почек. Клинические симптомы в начальной стадии ОПН тесно переплетаются с симптомами основного заболевания.
Как уже отмечалось, в течении ОПН традиционно выделяют четыре стадии: начальную (преданурическую), олигоанурическую, полиурическую и восстановительную. За исключением первой, для каждой из них характерна достаточно четкая клинико-лабораторная симптоматика.
Начальная (преданурическая) стадия ОПН. Эта стадия чрезвычайно разнообразна, и ее картина определяется, прежде всего, теми патологическими процессами, которые являются пусковым моментом для органического повреждения почек. Однако для этой стадии характерна олигурия. По остроте развития и клиническим особенностям состояния, сопровождающиеся преданурическим снижением диуреза, подразделяют на три типа.
Первый тип имеет острейшее начало. Он типичен для ОПН, возникающей как следствие шока любой этиологии (травматический, ожоговый, ангидремический, инфекционно-токсический и др.). Обычно при первичном инфекционном токсикозе у детей не ликвидированный в течение 4 ч спазм периферических сосудов приводит к прогрессивному ухудшению функции почек в ближайшие 12-24 ч, а присоединение тромбогеморрагического синдрома уже в течение первых 2 ч вызывает олигурию, сопровождающуюся макрогематурией с последующей продолжительной анурией. В случаях острой потери воды и солей, обусловленной неукротимой рвотой, истощающим поносом или ожогом, на первый план выступают симптомы обезвоживания. По мере углубления дегидратации и уменьшения объема циркулирующей крови нарастает олигурия. Моча имеет высокую относительную плотность. Мочевой осадок свидетельствует о гипоксическом поражении почек: протеинурия (6,6-9,9 мг/л), гиалиновые цилиндры (2-4 в поле зрения), эритроциты (8-10 в поле зрения), умеренная лейкоцитурия, кристаллы мочевой кислоты и мочекислого аммония. Степень азотемии в этой стадии не отражает состояние функции почек. Это объясняется сгущением крови и экстраренальным повышением содержания остаточного азота, мочевины, сопровождающими соледефицитную дегидратацию. Если дегидратацию вовремя не ликвидировать, наступающий вследствие ангидремии шок приводит к децентрализации кровообращения и анурии. Важнейшей особенностью О П Н при кишечных токсикозах и ожогах является развитие анурии на фоне артериальной гипотензии и резкого сгущения крови.
Второй тип характеризует продрома, проявляющаяся острым инфекционным, нередко нетяжелым заболеванием или состоянием, его имитирующим. У детей первых 3 лет жизни начало по типу острого респираторного или кишечного заболевания характерно для ГУС. Подобная симптоматика у больных более старшего возраста, особенно при наличии иктеричности склер, кожи из-за гипербилирубинемии при гемолитической анемии, крови в стуле, острого начала заболевания, как правило, является поводом для неоправданной госпитализации в инфекционное отделение с подозрением на острый вирусный гепатит или дизентерию.
Олигурию у большинства детей выявляют не сразу: на нее обращают внимание лишь после того, как у больного на фоне «стандартной» терапии обнаруживают признаки гипергидратации, либо трактовке заболевания не соответствуют лабораторные показатели (трансаминазы, азотемия, нарастающая анемия).
Третий тип течения преданурического периода развивается постепенно, в течение нескольких суток, и протекает со снижением диуреза на фоне основного заболевания (чаще вызванного бактериальной инфекцией) и его лечения. Это начало характерно для нарастающего первичного тубулоинтерстициального поражения при токсическом действии лекарств или генерализации септического процесса.
Олигоанурическая стадия. При нарастающей азотемии на фоне снижения диуреза диагноз ОПН, как правило, уже сомнений не вызывает.
Клиническая картина тесно связана с вариантом выхода в анурию. Чаще всего с начала заболевания до анурии проходят обычно 3-4 дня, иногда - 10 дней. Выраженный синдром диареи и нарастающей интоксикации, как правило, ведет к постепенному нарастанию уремии; угрожающее состояние развивается в первую очередь за счет гипергидратации, вызванной активной жидкостной терапией и несвоевременной диагностикой О П Н. На фоне диареи синдром гиперкалиемии не доминирует, возможна гипонатриемия. Метаболический ацидоз усугубляет тяжесть состояния больного. Характерна нарастающая анемизация (до 1,0-1,3 млн эритроцитов, гемоглобин - 60-70 г/л), возможна тромбоцитопения (до 20-30 тыс.).
При анурии у больных имеется симптоматика нарушения функции ЦНС (преимущественно угнетение) и желудочно-кишечного тракта (анорексия, рвота, боли в животе, неустойчивый стул), сердечно-сосудистые расстройства (тахиаритмия, артериальная гипер- или гипотензия, склонность к сосудистым коллапсам). Эта клиническая симптоматика является отражением двух клинико-лабораторных синдромов: гипергидратации и уремической интоксикации, которая обусловлена расстройствами кислотно-основного состояния, нарушениями обмена воды и электролитов, азотемией и накоплением олигопептидов в крови.
В последние годы большое внимание в генезе уремической интоксикации уделяют так называемым «средним» молекулам, содержание которых определяет сосудистый характер интоксикации. Клинические проявления этих экстраренальных синдромов могут быть как компенсированными, так и декомпенсированными (табл. 107).

Полиурическая стадия ОПН. Проявляется постепенным восстановлением водовыделительной функции почек. Несмотря на это, в состоянии больных длительное время нет особого улучшения, и доминируют симптомы астении. Помимо снижения массы тела, в клинической картине преобладают вялость, безразличие к окружающему, заторможенность. У больных выявляют гипотонию мышц, возможны гипорефлексия, парезы и параличи конечностей. Эта симптоматика связана с возникающей дегидратацией и дисэлектролитемией. В моче содержится много белка, лейкоцитов, эритроцитов, цилиндров, что связано с выделением погибших клеток канальцевого эпителия и рассасыванием интерстициальных инфильтратов.
Во время ранней полиурической фазы концентрационная способность почек остается крайне низкой (относительная плотность мочи 1.001 - 1.005), а расход воды почками - высоким. Ионов натрия выделяется почками в этот период относительно меньше, чем воды, и гипонатриемия сменяется гипернатриемией. Несмотря на полиурию, выделение мочевины и креатинина практически отсутствует. Возможно в течение нескольких суток продолжающееся увеличение содержания азотистых продуктов в крови за счет преобладания процессов катаболизма. Из-за значительных потерь ионов калия с мочой его концентрация в крови резко снижается. Возрастает опасность тяжелых расстройств водно-электролитного обмена, в связи с чем полиурическую стадию часто называют критической. На период восстановления диуреза приходится 37% всех случаев летальности от ОПН.
В конце 2-й недели улучшается азотовыделительная функция почек, стабилизируется диурез, постепенно восстанавливается водно-электролитный гомеостаз. Длительность полиурической стадии может затягиваться до 10-15 недель, снижение клеточного и гуморального иммунитета предрасполагает к присоединению инфекционных заболеваний верхних дыхательных путей и мочевыделительной системы. Около 80% больных в этом периоде переносят ту или иную инфекцию, которая является причиной 25% всех смертельных исходов в поздней полиурической стадии.
Стадия выздоровления. Этот период характеризуется медленным восстановлением утраченных функций и продолжается 6-24 месяца. Состояние больного постепенно стабилизируется, становится удовлетворительным, но могут сохраняться слабость, быстрая утомляемость. Полностью нормализуются водно-электролитный обмен, азотовыделительная функция почек, КОС крови. Постепенно восстанавливается эритропоэтическая функция костного мозга. Увеличение клубочковой фильтрации происходит медленно. Еще медленнее регенерируют почечные канальцы. В течение длительного времени сохраняются низкая относительная плотность мочи (1.006-1.002), склонность к никтурии, причем даже через два года нарушения функции клубочкового аппарата выявляются у 1/3 больных. Положительная динамика анализов мочи характеризуется исчезновением протеинурии, нормализацией мочевого осадка в течение 6-28 месяцев. Ликвидация симптомов поражения сердечнососудистой, пищеварительной и других систем происходит быстрее.
ДИАГНОСТИКА. Первым признаком, который заставляет врача заподозрить О П Н, является уменьшение диуреза. В этих случаях при трактовке патологической ситуации необходимо придерживаться следующей последовательности:
1) провести сбор анамнеза и клиническое обследование;
2) оценить возможные клинико-лабораторные признаки нарушения функций почек;
3) учесть степень и характер изменения гомеостаза;
4) провести дифференциальный диагноз между различными формами ОПН.
При подозрении на развитие ОПН у больного необходимо оценить диурез, относительную плотность мочи и мочевой осадок. Диурез при ОПН может быть снижен абсолютно (олигурия) или относительно по сравнению с объемом водной нагрузки. Возможна также полиурия. Абсолютная олигурия характеризуется снижением диуреза - суточный объем мочи менее 0,5 мл на 1 кг массы тела в час. Исключение составляют первые 3-4 дня жизни, когда диурез может отсутствовать даже у здоровых детей.
Диагноз преренальной формы ОПН обосновывают по следующим данным:
1) анамнез: указания на рвоту, диарею, травмы, кровотечения, нефротический синдром, сердечную недостаточность и др.;
2) клиническое обследование: признаки дегидратации (сухость слизистых оболочек, сниженный тургор, тахикардия, артериальная гипотензия, отеки, низкие показатели центрального венозного давления и др.);
3) в мочевом осадке в большом количестве выявляются гиалиновые и зернистые цилиндры;
4) в моче снижено содержание натрия и воды, что проявляется:
А) низким уровнем натрия в моче (менее 15 ммоль/л);
Б) снижением экскретируемой фракции натрия (ЭФ) менее 1%;
![]()
В) высокой осмолярностью мочи (более 500 мосм/л).
Указанные изменения обусловлены тем, что почка на сниженную перфузию отвечает интенсивной реабсорбцией натрия и воды, что необходимо для поддержания объема циркулирующей крови. Поэтому почки выделяют концентрированную мочу.
Осмолярность мочи (ОМ) имеет линейную зависимость от ее относительной плотности. Эта зависимость может быть выражена следующей формулой: ОМ (мосм/л) = 26 (ОПМ+6), где ОПМ - относительная плотность мочи.
При расчете по этому варианту формулы получается наименьший процент ошибок при ОПМ (в пределах 1.006-1.035). С учетом этой формулы при известной относительной плотности можно рассчитать объем обязательного диуреза и дополнительной потери воды почкой, т. е. резервной водовыделительной способности почек;
5) отношение азота мочевины в крови к креатинину сыворотки крови выше 20 (в норме обычно - 10-15), т.е. азот мочевины в крови повышается не пропорционально сывороточному креатинину.
Это обусловлено тем, что реабсорбция мочевины в почке пассивно связана с реабсорбцией натрия и, следовательно, увеличение реабсорбции натрия сопровождается повышением реабсорбции мочевины и увеличением азота мочевины крови, тогда как реабсорбция креатинина не связана с реабсорбцией натрия;
6) отношение азота мочевины в моче и плазме крови выше 10 и креатинина в моче и крови выше 40;
Диагноз ренальной формы ОПН у детей обосновывают с помощью критериев, которые перечислены ниже:
1) анамнез: указание на перенесенные ранее заболевания почек, использование различных медикаментов, рентгеноконтрастных веществ и др.;
2) результаты клинико-инструментального обследования: сцинтиграфия почек позволяет подтвердить поражение почек; сонография - исключить обструкцию мочевых путей;
4) в моче повышено содержание натрия и воды, поскольку в результате поражения канальцев снижена их реабсорбция и это проявляется:
А) высоким уровнем натрия в моче (более 40 ммоль/л);
Б) повышением экскретируемой фракции натрия (ЭФ) более 3%;
В) низкой осмолярностью мочи (менее 350 мосм/л);
6) отношение концентрации креатинина в моче и крови меньше 20.
Дифференциально-диагностические критерии преренальной и ренальной ОПН представлены в таблице 108.

Постренальную форму ОПН предполагают на основании анамнеза (врожденные аномалии мочевых путей, травма), пальпации (объемное образование в боковых отделах живота или переполнение мочевого пузыря).
Проводят сцинтиграфию и сонографию почек, а при уровне креатинина в сыворотке крови менее 0,45 ммоль/л - также экскреторную уро графию. При анурии и подозрении на обструкцию мочевых путей показана цистоскопия и ретроградная пиелография.
Дифференциальная диагностика ОПН с острой декомпенсацией латентно протекающей ХПН должна быть одной из важнейших задач при анурии, возникшей как следствие декомпенсированной уропатии, связанной с врожденной аномалией мочевых органов. Тщательно собранный анамнез, клиническое обследование и оценка соответствующих лабораторных данных оказывают большую помощь в различии этих двух возможных причин. При сборе семейного анамнеза можно предположить наличие двусторонней аномалии почек, поликистоза, синдрома Альпорта, оксалоза, цистинурии и других наследственных заболеваний. Замечено, что как у новорожденных с пороком развития пупочных сосудов (одна пупочная артерия), так и у детей, имеющих значительное отставание в физическом развитии, наличие выраженных рахитических изменений скелета или множественных стигм дизэмбриогенеза заставляет заподозрить у ребенка урологическую патологию или врожденную дисплазию почечной ткани с выходом на ХПН.
Рецидивирующий хронический пиелонефрит, повторные гнойные воспалительные очаги, наличие системных заболеваний, при которых могут поражаться почки, указывают на вероятность хронического патологического процесса в почках. Об этом также свидетельствует выявление своеобразного желтоватого цвета кожи, сопутствующего длительной азотемической интоксикации, часто с зудящими расчесами, обнаружение гипертонической ретинопатии, кардиомегалии, маленький рост больного с рахитоподобными деформациями скелета, тотальное поражение зубов на фоне бледной слизистой оболочки рта и дистрофических изменений десен.
Обзорная рентгенограмма органов брюшной полости помогает диагностировать нефрокальциноз, который может быть обусловлен длительным почечным тубулярным ацидозом, невыявленным частичным некрозом коркового вещества у детей грудного возраста, гиперпаратиреоидизмом или интоксикацией витамином Б с прогрессирующей почечной недостаточностью. Изменение размеров почек, обнаруживаемое при рентгенологическом или ультразвуковом обследовании, может указывать на поликистозную болезнь почки, гидронефроз или нефросклероз, которые вызывают почечную недостаточность через длительный промежуток времени.
Таким образом, при диагностике О П Н и ее причин в педиатрии, прежде всего, необходимо учитывать возраст ребенка и характерную для него этиологическую структуру синдрома. Важное значение имеет своевременная дифференциальная диагностика между преренальной и ренальной О П Н. В диагностике помогают оценка анамнеза, выраженность ренальных и экстраренальных проявлений О П Н. Для выбора тактики и определения экстренности терапии следует оценивать степень гиперкалиемии, метаболического ацидоза и присоединения неврологической симптоматики.
ЛЕЧЕНИЕ ОПН. Лечение ОПН начинают, как правило, уже во время проведения лечебно-диагностических проб, когда идет борьба с гипоксией, ликвидация централизации кровообращения, расстройств водно-электролитного обмена. Все ситуации, которые способны привести к ишемии почечной ткани, рассматривают как ситуации, приводящие к развитию шокового периода, от эффекта лечения которого зависит исход заболевания.
Приступая к лечению больного с олигурией, необходимо быть уверенным в отсутствии нарушений сосудистого объема (наличие гипо- или гиперволемии). Желательны измерения уровня центрального венозного давления (ЦВД) и катетеризация центральных вен. Если нет волемических расстройств, то можно назначить маннитол или фуросемид для дифференциальной диагностики преренальных олигурии или для перевода олигурической почечной недостаточности в неолигурическую.
Лечение преренальной ОПН. Направлено на восстановление объема циркулирующей крови (ОЦК) и перфузии почек:
1) возмещение ОЦК и стабилизация гемодинамики: внутривенно вводят 20 мл изотонического раствора натрия хлорида и/или 5%-го раствора альбумина в течение первого часа;
2) если после восстановления ОЦК (ЦВК выше 5 мм рт. ст.) олигурия или анурия сохраняются, внутривенно вводят маннитол в виде 20%-го раствора в дозе 0,5 г на 1 кг в течение 10-20 мин. При этом на протяжении 1-3 ч диурез должен увеличиться примерно на 6-10 мл на 1 кг. Если этого не происходит, введение маннитола прекращают;
3) если диурез не восстанавливается, необходимо продолжить регидратацию в объеме 5-10 мл на 1 кг в час с ежечасной коррекцией и введением фуросемида в дозе 1-4 мг на 1 кг через 2 и 4 ч.
4) после восстановления ОЦК проводят пробу с фуросемидом, вводя его внутривенно в дозе 1 мг на 1 кг. Увеличение диуреза более чем на 2 мл на 1 кг в час свидетельствует о преренальной ОПН. Если сохраняется олигурия или анурия, необходимо исключить ренальную или постренальную ОПН.
Обязательным условием применения диуретиков при ОПН является величина уровня САД (выше 60 мм рт. ст.). У больных с низким артериальным давлением при отсутствии противопоказаний вводят кровезаменители волемического действия (альбумин, реополиглюкин) в дозе 10-15 мл на 1 кг массы тела, но чаще используют дофамин или допамин (в дозе 10 мкг на 1 кг в минуту).
Дофамин - предшественник адреналина, имеет четкий дозис-зависимый эффект. При назначении в дозе выше 15 мкг на 1 кг в минуту стимулирует альфа- и бета-адренорецепторы, повышает уровень артериального давления, увеличивает общее периферическое сосудистое сопротивление. При назначении в дозе 6-15 мкг на 1 кг в минуту стимулирует бета-адренорецепторы и оказывает кардиостимулирующий эффект (увеличивает частоту сердечных сокращений и сократимость миокарда), в дозе 1-5 мкг на 1 кг в минуту оказывает диуретический эффект за счет воздействия на дофаминовые рецепторы сосудов почек, повышает почечный кровоток, клубочковую фильтрацию, экскрецию натрия. Благоприятное действие при ОПН оказывают дозы дофамина 1-3 мкг на 1 кг в минуту в сочетании с повторным назначением фуросемида в дозе 1 - 2мг на 1 кг массы тела.
Маннитол - низкомолекулярный осмотический диуретик. При его применении повышается почечный кровоток. Он дает вазодилатационный эффект на сосуды коркового слоя почек, способствует улучшению клубочковой фильтрации, снижению сопротивления афферентных и эфферентных артериол за счет освобождения простагландинов. При его назначении увеличивается диурез и предотвращается снижение клубочковой фильтрации. При экспериментальной модели ОЛИ он уменьшает тяжесть поражения. Маннитоловый тест может быть отрицательным, если у больного отмечается дегидратация. При гиперволемии введение маннитола опасно в связи с возможностью развития отека легких. Препарат противопоказан также при сердечно-сосудистой недостаточности. Маннитол может быть использован для предотвращения обструкции канальцев. Однако при уже развившейся почечной недостаточности и тубулярном некрозе эффект от его применения отсутствует.
Фуросемид - петлевой диуретик, способствует расширению сосудов кортикального слоя почек, повышает осмолярный клиренс и ток жидкости в канальцах. Он ингибирует реабсорбцию ионов натрия, что приводит к; повышению диуреза. Повышение концентрации фуросемида в таки1а ёеШа может блокировать клубочково-канальцевые взаимоотношения, поэтому при ОПН эффект отсутствует. Фуросемид уменьшает степень почечной недостаточности в эксперименте при ее ишемической модели. Использование фуросемида дает хороший эффект на ранних стадиях. Первичная доза лазикса - 2 мг на 1 кг массы тела; если на нее нет реакции в течение часа, то можно ввести препарат повторно в дозе до 10 мг на 1 кг массы тела. Если реакции нет, то можно добавить низкие дозы дофамина (2-5 мкг на 1 кг в минуту). Если эти мероприятия не дают эффекта, а концентрация мочевины и креатинина нарастает, то диагноз ренальной ОПН не вызывает сомнения.
Важно помнить, что высокие дозы фуросемида могут оказать токсический эффект и способствовать повышению степени почечной недостаточности. Возможно, это усугубляется сопутствующей гиповолемией, и, хотя фуросемид может усилить диурез, это не повышает выживаемости больных.
Лечение ренальной ОПН. Лечение в олигоанурической стадии начинают тогда, когда проведен дифференциальный диагноз с преренальной ОПН. Терапия детей с олигоанурической стадией ОПН представляет собой комплексную программу, состоящую из 4 компонентов:
1) коррекция питания и поддержание водно-электролитного баланса;
2) ликвидация расстройств гомеостаза и поддержание кислотно-основного состояния;
3) активная детоксикация (гемосорбция, перитонеальный диализ, гемодиализ и др.);
4) профилактика и лечение осложнений ОПН.
Коррекция питания и водно-электролитного баланса. Детям, больным ОПН, с целью подавления катаболизма белков требуется высококалорийная диета. Энергетическая потребность составляет 70-100 ккал на 1 кг массы тела в сутки, а при полном парентеральном питании - 50- 60 ккал на 1 кг в сутки.
За счет белков должно обеспечиваться 3-5% суточной энергетической потребности. Высококалорийная низкобелковая диета способствует снижению катаболизма и уровня азота мочевины крови, уменьшению уремии и повышению эффективности лечения.
При поддержании баланса жидкости ограничение объема водной нагрузки проводят с учетом возможных потерь (сумма объемов жидкости, теряемой при перспирации, дополнительные патологические потери плюс объем, равный диурезу за предыдущие сутки). У больных с ОПН без компенсации потерь воды усугубляется гипоксия почечной ткани. Парадоксально, но больной при состояниях, сопровождающихся гиперкатаболизмом, нуждается в меньшем введении жидкости из-за избытка образования эндогенной воды, поэтому водная нагрузка у него может быть снижена на 1/3 от общей дозы.
Классическим вариантом поддержания водного баланса при ОПН является назначение жидкости, соответствующей потерям воды путем перспирации. Перспирация у новорожденного ребенка составляет 1,5 мл на 1 кг в час, у детей до 5 лет - 1 мл, а свыше 5 лет - 0,5 мл на 1 кг в час. У взрослых перспирация составляет 300-500 мл/сут. При наличии синдрома диареи и отсутствии отеков возможно добавление жидкости в объеме 10-20 мл на 1 кг в сутки.

Большинство исследователей считают, что для поддержания водного баланса у больных ренальной ОПН необходимо пользоваться следующим расчетом (табл. 109).
Важным фактором контроля за правильностью водной нагрузки является обязательное взвешивание ребенка 2 раза в сутки. Колебания массы тела не должны превышать 0,5-1% исходной массы тела в сутки. Чрезмерное увеличение массы тела - явный признак гипергидратации. Другим признаком гипергидратации является снижение концентрации ионов натрия (гипонатриемия разведения).
Существуют сторонники удаления жидкости при гипергидратации за счет лекарственной диареи (сорбитол - 1 г/кг внутрь). Однако любая жидкостная перегрузка фактически является первым показанием к раннему диализу.
Ликвидация расстройств гомеостаза. Гиперкалиемия при ОПН связана с потерей внутриклеточных электролитов, тканевыми повреждениями или гемолизом. У больных с гипертермией, травмой, ожогами гиперкалиемия нарастает быстрее. Развитию гиперкалиемии способствует ацидоз, при котором на каждую 0,1 единицы снижения рН содержание калия в плазме увеличивается на 0,5 ммоль/л. При ОПН для профилактики гиперкалиемии необходимо полностью исключить поступление солей калия с пищей, лекарственными препаратами. Введение консервированной крови, содержащей 30 ммоль/л калия, может привести к гиперкалиемическим осложнениям.
Гиперкалиемия опасна для жизни, так как может привести к остановке сердца. Если концентрация калия быстро нарастает или превышает 6 ммоль/л, то необходимо в первую очередь назначить антагонисты калия, блокирующие электрофизиологический эффект гиперкалиемии (табл. 110). Следует ввести 10%-й раствор кальция глюконата в дозе 0,5-1 мл на 1 кг (20 мг на 1 кг) массы тела внутривенно, медленно, в течение 5-10 мин, при тщательном наблюдении за частотой сердечных сокращений (ЧСС). Эту дозу можно ввести дважды. Эффект появляется через 30-60 мин. При уменьшении ЧСС на 20 ударов в 1 мин инфузию прекращают до тех пор, пока ЧСС не достигнет первоначального значения.
Таблица 110

При гиперкалиемии показано введение 8,4%-го раствора натрия гидрокарбоната, который вводят внутривенно струйно в течение 10-20 мин в дозе 2-3 ммоль на 1 кг (1-2 мл на 1 кг), который разводят 10%-м раствором глюкозы в соотношении 1:2.
При сохранении гиперкалиемии внутривенно вводят 20%-й раствор глюкозы в количестве 2 мл на 1 кг (0,5 г на 1 кг) в течение 30 мин с добавлением 0,1 ЕД инсулина на 1 кг (1 ЕД инсулина на 4 г глюкозы). В случае необходимости введение повторяют через 30-60 мин.
Возможно удаление калия интестинальным путем с помощью энтеросорбции калия. Для этого назначают калийобменную смолу (Resonium A, Sorbisterit, Elutit-Nа) по 0,5-1,5 г на 1 кг в сутки внутрь или в виде клизмы с 30-50 мл 10%-го раствора глюкозы.
При повышении уровня калия в пределах 5,5-7 ммоль/л можно ввести полистиролсульфонат натрия (1 г на 1 кг) в сочетании с 70%-м раствором сорбитола 0,5 мл на 1 кг перорально или 1,0-1,5 мл на 1 кг ректально.
Указанный комплекс мероприятий обоснован тем, что глюконат кальция не способствует снижению в сыворотке уровня калия, но противодействует калиииндуцированному повышению возбудимости миокарда, тогда как натрия гидрокарбонат снижает уровень калия в сыворотке, а глюкоза и инсулин способствуют перемещению калия из внеклеточного пространства во внутриклеточное.
При этом нужно помнить, что при выведении 1 мэкв калия высвобождается 1 мэкв натрия, поэтому со временем может развиться гипернатриемия.
Продолжительность мероприятий составляет несколько часов. Персистирующая гиперкалиемия, особенно у больных, которым требуется проведение неотложных мероприятий, должна купироваться при помощи гемодиализа.
Метаболический ацидоз - наиболее частый вид нарушения КОС на начальных этапах анурии. Первыми по нормализации КОС должны быть мероприятия, направленные на восстановление витальных функций, прежде всего - восстановление периферической, центральной гемодинамики и дыхания. Чем эффективнее терапия этих патологических синдромов, тем меньше необходимость в дополнительной коррекции КОС.
В лечении ацидоза существенное значение имеют обильное промывание желудка и кишечника щелочными растворами и питье щелочных вод, назначение натрия гидрокарбоната внутривенно. Показанием к этой терапии является отсутствие у больного неукротимых рвот, которые предрасполагают к метаболическому алкалозу. Во всех других случаях при терапии ОПН необходимо проведение регулярного и осторожного ощелачивания.
Натрия гидрокарбонат назначают в дозе 0,12-0,15 г сухого вещества на 1 кг массы тела ребенка или по 3-5 мл 4%-го раствора на 1 кг массы тела в течение суток дробно в 4-6 приемов. Необходимо относиться с осторожностью к применению концентрированных растворов препарата у новорожденных из-за опасности развития внутричерепных кровоизлияний.
Несмотря на патогенетическую необоснованность возникновения метаболического алкалоза при анурии, у части детей на фоне значительных потерь желудочного содержимого он является доминирующим в кислотно-основных расстройствах.
Лечение метаболического алкалоза является трудной задачей. До настоящего времени не существует эффективных средств, которые оказывали бы подкисляющее действие и успешно применялись в клинике. В связи с тем, что метаболический алкалоз обычно сочетается с гиперхлоремией, при его лечении в первую очередь необходимо проводить коррекцию данных расстройств. Электролиты назначают с учетом возрастной физиологической потребности ребенка в них. В последние годы для лечения метаболического алкалоза используют внутривенное введение 0,1-0,25%-го раствора хлористоводородной кислоты в дозе 5- 10 мл/ч до нормализации рН крови. Противопоказаниями к введению хлористоводородной кислоты являются снижение осмотической стойкости эритроцитов и гемолиз.
У детей с ОПН неспособность почек экскретировать фосфор приводит к гиперфосфатемии и реципрокной гипокальциемии. Ацидоз предотвращает развитие тетании путем увеличения ионизированной фракции общего кальция. При быстрой коррекции ацидоза снижается уровень ионизированного кальция, что приводит к тетании. Снижению уровня фосфора способствуют фосфорсвязывающие препараты, способствующие увеличению экскреции фосфатов с калом, чаще всего используют альмагель (гидроокись алюминия) - 1-3 мл на 1 кг в сутки в 4 приема; общая дневная доза увеличивается постепенно до тех пор, пока уровень фосфора в сыворотке не приблизится к норме.
Гипокальциемия требует осторожной коррекции, она корригируется за счет снижения фосфатов. Если тетания не развивается, кальций не вводят внутривенно, чтобы произведение концентрации в сыворотке кальция (мг/л) и фосфора (мг/л) не превысило 70, так как при этой величине соли кальция откладываются в тканях. При значительной гиперфосфатемии коррекция необходима с целью повышения низкого уровня кальция сыворотки, она осуществляется пероральным применением связывающих фосфат соединений гидроксид алюминия или карбонат кальция. Введение глюконата кальция с этой целью применяется при риске возникновения судорог.
Кальция глюконат в виде 10%-го раствора вводится внутривенно в дозе 065-1 мл на 1 кг или 0,5-1 г кальция в сутки внутрь.
Гипонатриемия развивается в результате длительного потребления или введения гипотонических растворов. Обычно достаточно ограничить прием жидкости и ввести фуросемид, чтобы нормализовался уровень натрия в сыворотке. При уровне натрия менее 120 ммоль/л и появлении признаков водной интоксикации - отек головного мозга и кровоизлияния в него - необходимо вводить внутривенно 3%-й раствор хлорида натрия. Расчет проводят по следующей формуле:
Необходимое количество хлорида натрия (мэкв) =
0,6 масса тела (кг) (125 - натрий (ммоль/л, в сыворотке).
Коррекция делжна проводиться крайне осторожно, чтобы избежать осложнений: еще большего увеличения объема циркулирующей крови, гипертензии, недостаточности кровообращения, требующих лечения при помощи диализа.
Лабораторные критерии Адекватности терапии контролируют по концентрации в сыворотке кро/ви натрия, калия, хлора, белка, мочевины, креатинина, глюкозы, показателям КОС.
Детоксикационная терапия. Интоксикация при О П Н полиэтиологична. Она обусловлена нарушениями водно-электролитного обмена (гипергидратация, гиперволемия), метаболическим ацидозом, накоплением азотистых продуктов (аммиак, мочевина, мочевая кислота), средних молекул (олигопептидов) и инфекционным фактором, предшествующим развитию О П Н.
В связи с этим детоксикационная терапия должна быть направлена на активное поддержание постоянства водно-электролитного гомеостаза и КОС, уменьшение накопления, активное выведение продуктов азотистого обмена и удаление олигопептидов.
Для решения этих задач применяют различные методы активной детоксикации, к которым относят перитонеальный диализ, гемосорбцию и гемодиализ. Самым эффективным методом для детоксикационной терапии ОПН является гемодиализ, который может быть дополнен ультрафильтрацией и гемофильтрацией.
Все показания к активным методам детоксикации можно разделить на относительные и абсолютные. Это деление достаточно условно.
Относительные показания возникают тогда, когда этиологический фактор обусловливает прогредиентное течение ОПН (тубулоинтерстициальные поражения лекарственного происхождения, нарушения, возникающие вследствие электролитных расстройств, ОПН у новорожденных), при наличии компенсированных электролитных расстройств, при увеличении массы тела, запахе аммиака изо рта, кожном зуде, беспокойстве, отказе от еды, гастроэнтерите, расстройствах сна, ацидотическом дыхании, слабости, апатии, тахикардии, артериальной гипертензии, при изменении сухожильных рефлексов. Всю симптоматику необходимо учитывать в совокупности.
Абсолютными показаниями к гемодиализу (табл. 111) в период анурии могут быть быстрое нарастание темпа уремической интоксикации - повышение уровня мочевины и остаточного азота на 21,4- 28,5 ммольДл сут), креатинина - на 0,18-0,44 ммоль/(л сут), гиперкалиемии выше 7 ммоль/л и выраженная гипергидратация.
Клиническими критериями для начала диализной терапии являются нарастание неврологической симптоматики, углубление степени комы, появление судорожного синдрома, клинико-лабораторных признаков шокового легкого.
Относительные показания целесообразно учитывать в отделениях интенсивной терапии, в которых проводится гемодиализ. В этих случаях применяют перитонеальный диализ, заменное переливание крови, реже - гемосорбцию.
Таблица 111

Перитонеальный диализ может проводиться только в условиях реанимационного отделения при совместной работе нефролога, реаниматолога, хирурга. Под общим обезболиванием осуществляют лапароцентез в надчревной области с обеих сторон. Через лапаротомические отверстия вводят 4 катетера по направлению к малому тазу. Через 2 из них, которые расположены более поверхностно, вводят диализирующие растворы, а через 2 других, расположенных ниже и глубже, удаляют их. Больному придают положение Федорова-Фовлера.
Количество жидкости, требующейся для осуществления однократного промывания брюшной полости, зависит от возраста ребенка. Вопрос о числе повторных сеансов перитонеального диализа решается индивидуально.
Для проведения перитонеального диализа можно пользоваться раствором Рингера с добавлением к нему глюкозы из расчета 70-80 г на 1 л, а при необходимости ускорения диализа или выведения из организма большого объема воды добавляют 5%-й раствор альбумина. Производят подщелачивание применяемой жидкости, добавляя к ней 1 г натрия гидрокарбоната на 1 л жидкости. С целью профилактики перитонита в диализирующий раствор вводят антибиотики в суточной возрастной дозе (ампициллин, канамицин, левомицетин).
Во избежание водной перегрузки при проведении перитонеального диализа необходим тщательный учет соотношения объема жидкости, введенной в брюшную полость и выведенной из нее. Перед завершением процедуры перитонеального диализа следует провести контроль ионограммы сыворотки крови и при необходимости - коррекцию ее. Возможно проведение перитонеального диализа до появления диуреза. В последние годы в связи с появлением специальных катетеров и диализирующих растворов (фирма Baxter) процедура перитонеального диализа значительно упростилась. Он постепенно становится ведущим методом для детоксикации при ОПН у детей раннего возраста.
Гемодиализ является наиболее эффективным, но самым сложным методом детоксикации. Для его проведения необходима не только специальная аппаратура, но и опыт по его использованию у детей первых лет жизни. Особенности применения зависят от возраста ребенка, причины развития ОПН и продолжительности анурии.
У новорожденных основной целью диализной терапии является ликвидация гиперкалиемии и гиперазотемии. С учетом относительно высокого возрастного уровня ионов калия в плазме и большой частоты экстраренальной азотемии показаниями к гемодиализу являются концентрация калия плазмы более 7-8 ммоль/л, ежесуточный прирост концентрации мочевины на 5-7 ммоль/л и ацидоз с дефицитом оснований не менее 15 ммоль/л. В связи с относительно быстрой скоростью нарастания уремической интоксикации необходимость гемодиализа у новорожденных возникает к концу первых и в начале вторых суток анурии. Из-за опасности развития синдрома перераспределения продолжительность диализа не должна превышать 45-60 мин. При эффективности лечения достаточно проведения 1-2 сеансов детоксикации.
У детей до 5 лет экстракорпоральные методы очищения необходимы при следующих ситуациях:
Продолжающийся ДВС на фоне олигурии при первичном ГУС;
Нарушения водно-электролитного обмена и КОС, являющихся как причиной ОПН, так и следствием ее неадекватной терапии;
Уремическая интоксикация.
Если доминирует необходимость решения первой задачи, то, как правило, гемодиализ назначают вне зависимости от других показателей. Его проводят ежедневно до исчезновения признаков прогрессирования ДВС. При преобладании нарушений водно-электролитного обмена и КОС необходимо проведение экстренного гемодиализа при отеке легкого, отеке головного мозга, гиперкалиемии свыше 6,5 ммоль/л и ацидотической коме. В этих случаях основным компонентом гемодиализа является проведение ультрафильтрации с тем, чтобы в течение 1-2 сеансов ликвидировать декомпенсацию. Уремическая интоксикация является показанием к гемодиализу в том случае, если суточный прирост мочевины составляет 3-5 ммоль/л. Существенное повышение эффективности терапии в этих случаях достигается сочетанием гемодиализа с гемосорбцией. Критерием эффективности проводимой терапии является стабилизация состояния больного и лабораторных показателей в течение первых 3-5 суток лечения. С этого момента показанием для последующих гемодиализов является скорость нарастания уровня мочевины в междиализном периоде.
Тактика диализной терапии. У детей до 3 лет в первые сутки возможно проведение даже двух сеансов гемодиализа с промежутком до 4- 6 ч, а в дальнейшем сеансы проводят до стабилизации показателей, уменьшения темпа накопления мочевины, снижения содержания средних молекул, мочевой кислоты. Диализ проводят ежедневно до появления диуреза. Цель гемодиализа - поддержание нулевого водного баланса, коррекция электролитов и КОС. Период анурии продолжается, как правило, до 10-20 дней (по нашим наблюдениям, максимальный срок анурии с дальнейшим благоприятным исходом - 35 сут). Появление диуреза позволяет проводить гемодиализ через день. Тогда же после сеанса гемодиализа вводят диуретики (до 5-10 мг на 1 кг лазикса). Реакция на них в первое время отсроченная, сомнительная. Появление отчетливой реакции на введение диуретиков является, как правило, показанием к прекращению диализной терапии.
У детей школьного возраста необходимость в ежедневном диализе составляет меньший промежуток времени, при этом время диализа увеличивается. Появление диуреза и даже выход в полиурию у детей старше 7-10 лет не является показателем скорого прекращения диализной терапии; появление на этом фоне нарастающего гипертензионного синдрома является плохим прогностическим признаком.
При подозрении на болезнь Мошковича заполнение аппарата производят плазмой, ее же переливают в междиализном периоде в больших дозах. Если нет эффекта в первые 2-3 суток, то процесс необратим.
Лечение политической стадии ОПН. С появлением диуреза начинается восстановление функционального состояния почек. Поэтому в полиурическую стадию ОПН необходимо изменить водный режим и электролитную нагрузку. Ребенку не ограничивают употребление жидкости или поваренной соли, дополнительно назначают препараты калия. Постепенно расширяют диету и в первую очередь увеличивают калорийную нагрузку. В остальном принципы терапии остаются такими же, как и в период анурии. При лечении больных ОПН с использованием гемодиализа полиурическая стадия короткая и протекает благоприятно.
Контроль за состоянием больного, помимо обычного клинического, должен обязательно включать постоянное тщательное наблюдение за диурезом и относительной плотностью мочи, динамикой массы тела, монограммой сыворотки крови, показателями КОС и концентрацией остаточного азота или мочевины сыворотки крови.
Основными осложнениями полиурического периода могут быть энергодефицит или сердечная недостаточность, обусловленная гипокалиемией, астенический синдром и гипотрофия. Последняя связана, как правило, с неадекватным питанием ребенка. Основным принципом при лечении сердечной недостаточности является усиление нагрузки препаратами калия (калия ацетат, панангин) в общей дозе до двух возрастных потребностей в электролитах.
Для профилактики гипотрофии наиболее адекватно энергетическое обеспечение соответствующей гиперкатаболической фазы, т.е. в пределах удвоенного возрастного объема. Постепенно увеличивается белковая нагрузка на 0,5 г в каждую неделю, но не выше 1,5-2 г на 1 кг. Первостепенное значение приобретают жирорастворимые витамины А, Е и мембранопротекторы (эссенциальные фосфолипиды).
По мере нормализации уровня мочевины, восстановления клубочковой фильтрации до 1/2 или 2/3 от возрастной нормы больного можно выписать на амбулаторное наблюдение домой, не дожидаясь нормализации показателей красной крови и относительной плотности мочи. Для достижения этих целей важно обеспечить домашний режим для ребенка, профилактику инфекционных заболеваний, полноценное питание, прогулки.
Запрещается посещение детских учреждений, проведение профилактических прививок и введение гамма-глобулина, ограничивается назначение любых лекарственных препаратов, активно проводится физиотерапия. Осмотр ребенка через 1 мес, затем - через 3 мес, в дальнейшем - через каждые 6 мес. с контролем анализа крови, биохимических анализов, пробы Реберга и пробы Зимницкого. Рентгенологическое обследование с рентгеноконтрастными йодсодержащими препаратами по мере необходимости желательно проводить через 1,5- 2 года после выписки.
Лечение постренальной ОПН. Заключается в устранении препятствия оттоку мочи путем поэтапной хирургической коррекции обструктивной уропатии.
Исходы ОПН. Методы экстракорпоральной детоксикации снизили летальность при ОПН, однако она остается довольно высокой, достигая 20-40%. Высокая летальность большей частью обусловлена тяжестью основного заболевания, осложняемого ОПН.
Профилактика и лечение осложнений ОПН. Наиболее частыми осложнениями ОПН у детей являются синдром гипергидратации, отек легкого, отек мозга, инфекционные заболевания, желудочно-кишечные кровотечения. Они возникают при поздней постановке диагноза ОПН и наблюдаются обычно в диализном периоде. Синдром гипергидратации закономерно развивается в период анурии. Он возникает вследствие несоответствия объемов поступления воды и выведения ее. Гипергидратации способствуют образование большого количества эндогенной воды, введение раствора глюкозы и натрия хлорида с лечебной целью. В результате гипергидратации развиваются гиперволемия, отек интерстициальной ткани органов.
Синдромная терапия гипергидратации должна быть экстренной только при появлении клинических признаков отека легкого и отека мозга. В тех случаях, когда при гипергидратации возникают полостные и периферические отеки, необходима «выжидательная» тактика, которая включает максимально возможное ограничение водной нагрузки, увеличение потери жидкости через желудочно-кишечный тракт (с применением солевых слабительных, оказывающих осмотическое действие), и, при возможности, назначение салуретиков.
Лечение отека легких. Терапия отека легких включает комплекс мероприятий, направленных на решение двух основных задач: борьбы с гипоксией и ликвидации отека. Борьбу с гипоксией осуществляют на основе общих принципов респираторной терапии. Применяют пеногасители - проводят ингаляцию газовой смеси, содержащей пары 33%-го раствора этилового спирта, налитого в количестве 100 мл в увлажнитель или аппарат Боброва. Хороший противовспенивающий эффект оказывает кремнийорганический полимер антифомсилан, 10%-й раствор которого наливают в ингалятор или аппарат Боброва. Парами препарата дают дышать через маску в течение 15 мин. Эффект антифомсилана наступает через 3-4 мин, в то время как от ингаляции этилового спирта - через 20-30 мин.
Обязательно проведение оксигенотерапии, периодического отсасывания слизи и пены из верхних дыхательных путей. При прогрессировании гипоксии больного переводят на вспомогательное дыхание под постоянным положительным давлением по методике Грегори или с применением мешка Бауэра-Мартина. Величину давления подбирают по клиническому эффекту в пределах от +6 до +12 см вод. ст. Большое значение в лечении отека легких имеют ганглиолитики. Следует назначать также антигистаминные препараты, кальция глюконат, аскорбиновую кислоту, рутин. Показанием к переводу на ИВЛ является прогрессирующая гипоксия, не уменьшающаяся под влиянием других методов оксигенации, а также сочетающаяся с артериальной гипотензией.
Лечение отека головного мозга. Должно быть направлено на профилактику и ликвидацию гипоксии: поддержание свободной проходимости верхних дыхательных путей, оксигенотерапию, при глубокой коме - искусственную вентиляцию легких (ИВ Л). Большое значение имеет выбор режима ИВЛ - показана умеренная гипервентиляция со снижением Рсо крови не более чем до 30-28 мм рт. ст. Окончательно подход к терапии зависит от стадии неврологических расстройств.
При клеточном отеке - набухании головного мозга, который сопровождается глубокой среднемозговой комой, основным моментом лечения является ликвидация энергодефицита. Назначают 20%-й раствор глюкозы с эуфиллином, при отсутствии гиперкалиемии - панангин. Положительный результат дает гипотермия в пределах 29-30° С. Наиболее простым способом охлаждения является обкладывание головы пузырями со льдом. Охлаждение также может быть достигнуто с помощью аппарата для проведения краниоцеребральной гипотермии «Холод».
Особо следует остановиться на лечении судорожного синдрома как наиболее частого и грозного осложнения анурии. Его развитие обусловлено в основном гипергидратацией с отеком мозга или нарушением мозгового кровообращения на фоне гипертензионного синдрома. В более поздние сроки анурии в происхождении судорог может играть роль нарушение фосфорно-кальциевого обмена. Судороги, обусловленные отеком мозга, чаще снимаются введением натрия оксибутирата (150 мг на 1 кг массы тела).
Коррекция метаболического ацидоза и назначение препаратов кальция - 2 мгДкг-ч) 10%-го раствора кальция глюконата (разовая доза) способствует ликвидации судорожного синдрома.
Нарушение мозгового кровообращения, как правило, сопровождается появлением очаговой симптоматики на фоне гипертензионного синдрома. Такое сочетание - плохой прогностический признак и является абсолютным показанием к диализной терапии. Оправдано назначение ганглиоблокаторов (пентамин, бензогексоний) и препаратов, улучшающих мозговой кровоток (пирацетам, кавинтон). В исключительных случаях возможно кровопускание в объеме 5-7 мл крови на 1 кг массы тела.
Гипертензионный синдром. Может быть обусловлен не только гипергидратацией. Его сохранение при отсутствии судорог, как правило, указывает на его ренальное происхождение. В этих случаях консервативная терапия (эуфиллин, папаверин, дибазол) неэффективна.
Клиника ОПН включает четыре периода (стадии):
1) период действия этиологического фактора;
2) период олигурии - анурии, при котором суточный диурез составляет менее 500 мл (длительность до 3 недель);
3) период восстановления диуреза с фазой начального диуреза (когда количество мочи превышает 500 мл в сутки) и с фазой полиурии (количество мочи 2-3 л и более в сутки), длительность до 75 дней;
4) период выздоровления, начинающийся с момента нормализации азотемии.
Примерно у 10 % больных наблюдается неолигурическая ОПН , т. е. изменения биохимических показателей крови возникают на фоне нормального или даже повышенного диуреза. Наиболее частой причиной неолигоурической ОПН является острый интерстициальный нефрит.
Острый интерстициальный нефрит (ОИН) – мультифакторное диффузное заболевание почек с преимущественным поражением тубулоинтерстициальной ткани. Морфологически ОИН характеризуется отеком интерстиция, более выраженным в мозговом слое, неравномерной очаговой инфильтрацией моно- и полинуклеарами. Характерна плазмоклеточная инфильтрация, дистрофия или атрофия эпителия канальцев. В клубочках развивается умеренная сегментарная мезангиальная пролиферация, увеличение мезангиального матрикса, склерозирование клубочков.
Наиболее частой причиной острого ОИН является воздействие лекарственных препаратов, в первую очередь антибиотиков, а также ряда химических веществ. ОИН нередко развивается после введения сывороток и вакцин. До сих пор не понятно - почему среди огромного количества больных, принимающих различные лекарственные препараты, ОИН развивается сравнительно у небольшого числа лиц. Острое начало заболевания в первые часы или дни приема препарата считается типичным для ОИН. Характерны: лихорадка, эозинофиллия, снижение функции почек, кратковременная аллергическая сыпь. При развернутой клинической картине типичен мочевой синдром: гематурия, лейкацитурия, умеренная протеинурия, эозинофилия, возможны эритроцитарные цилиндры.
Для клинической картины и течения ОИН характерны следующие признаки:
на фоне полиурии рост уровня креатинина в плазме крови, начинается с первых суток;
сочетание креатинемии, полиурии с протеинурией и гематурией;
отсутствие гиперкалиемии;
развите олигурии при ОИН, может быстро сменится полиурией, однако рост уровня кретинина сохраняется.
Клиническая картина опн
Ранние клинические признаки (предвестники) ОПН часто минимальны и непродолжительны - почечная колика при постренальной ОПН, эпизод острой сердечной недостаточности, циркуляторный коллапс при преренальной ОПН. Нередко клинический дебют ОПН замаскирован экстраренальными симптомами (острый гастроэнтерит при отравлении солями тяжелых металлов, местные и инфекционные проявления при множественной травме, системные проявления при лекарственном ОИН). Кроме того, многие ранние симптомы ОПН (слабость, анорексия, тошнота, сонливость) неспецифичны. Поэтому наибольшую ценность для ранней диагностики имеют лабораторные методы: определение уровня креатинина, мочевины и калия в крови.
Клинические проявления появляются в олигоанурическом периоде. В этом периоде имеется фаза «мнимого» благополучия, которая может длиться до нескольких дней и фаза интоксикации, обусловленная водноэлектролитными нарушениями, изменениями КЩС и азотовыделительной функции почек. Полиморфизм признаков ОПН обусловлен клиническими проявлениями нарушений 5 основных почечных функций, обеспечивающих гомеостаз: изоволюмии, изоионии, изоосмии, изогидрии, азотемии. Для ОПН наиболее характерными проявлениями являются:
Анурия (диурез менее 50 мл).
Олигурия (диурез менее 500 мл) Ежедневно с мочой должно выводиться 400-500 мосм. веществ (мочевина, креатинин, мочевая кислота, аммиак, электролиты), которые являются продуктами нормального метаболизма. При физических нагрузках и патологических состояниях, сопровождающихся повышением катаболизма, данная нагрузка возрастает. Максимальная осмолярность мочи у здорового человека достигает 1200 мосм./кг, для экскреции суточной осмотической нагрузки объём мочи должен составлять не менее 400-500 мл. Соответственно, при суточном количестве мочи менее 500 мл происходит накопление в организме конечных продуктов азотистого обмена.
Азотемия- повышение содержания мочевины и креатинина в крови.
Гиперкалиемия - повышение концентрации калия в сыворотке до уровня более 5,5 мэкв/л
Метаболический ацидоз - со снижением уровня бикарбонатов в сыворотке до 13 ммоль/л
Тяжелое нарушение функции иммунной системы - угнетаются фагоцитарная функция и хемотаксис лейкоцитов, подавляется синтез антител, нарушается клеточный иммунитет (лимфопения). Поэтому острые инфекции - бактериальные и грибковые развиваются у 30-70% больных ОПН и часто определяют прогноз больного.
КЛИНИЧЕСКАЯ СИМПТОМАТОЛОГИЯ ОСНОВНЫХ ВОДНОЭЛЕКТРОЛИТНЫХ НАРУШЕНИЙ ПРИ ОПН.
|
1.Внеклеточная дегидратация |
Гиповолемия, кожа сухая, бледная, тургор снижен, иктеричность склер снижение АД, пульс нитевидный, одышка |
|
2.Клеточная дегидратация |
Жажда, повышение температуры тела, головные боли, психомоторные расстройства, судороги |
|
3.Гипергидратация |
Одышка, отеки, повышение АД, отек легких |
|
4.Гипокалиемия |
Резкая сонливость (или кома), адинамия, речь замедлена, глубокие рефлексы отсутствуют, паралитическая кишечная непроходимость, увеличение границ сердца, тахикардия, аритмия, ЭКГ-симптомы (снижение вольтажа, депрессия сегмента SТ, инверсия зубца Р) |
|
5.Гиперкалиемия |
Апатия, сонливость, судороги, гипотензия, брадикардия, одышка, аритмия; ЭКГ-симптомы (увеличение зубца Т, снижение интервала SТ ниже изоэлектрической линии, уширение комплекса QRS, уплощение зубца Т, нарушения проводимости). |
|
6.Гипонатриемия |
Апатия, гипотензия, тахикардия, боли в мышцах, ортостатические коллапсы, патологические дыхательные ритмы. |
|
7.Гипокальциемия |
Тетания, повышение нервно-мышечной возбудимости, спазм гортани, асфиксия. |
|
8.Гипермагниемия |
Поражение центральной нервной системы (депрессия, психические расстройства, кома). |
Длительность олигурической фазы зависит от:
выявления и устранения причин его развития,
от тяжести поражения почек,
эффективности проводимого специализированного лечения.
В среднем продолжительность олигурии составляет 7 – 12 суток. При отравлении этиленгликолем, краш-синдроме, акушерско-гинекологической патологии продолжительность олигурии составляет до 4 недель, а при их осложненном течении – до 6 недель. Когда через 4 недели лечения не наблюдается восстановление диуреза, то надо думать о возможном развитии кортикального некроза и формировании «первичной» ХПН.
Почечная недостаточность — болезненное состояние, при котором затрудняется или полностью отсутствует функция выделения мочи.
Постоянные застои жидкости внутри мочевыделительной системы приводят к нарушениям осмотического давления, кислотно-основного равновесия и накоплению токсических азотистых веществ в организме человека.
Заболевание может быть двух типов:
- Острая почечная недостаточность;
- Хроническая почечная недостаточность.
Рассмотрим оба типа заболевания подробнее.
Острая почечная недостаточность
При данном недуге количество мочи резко снижается, или же сводится к нулю (возникает анурия).
Острый тип почечной недостаточности возникает вследствие нескольких причин, связанных с нарушением функционирования различных органов:
- Преренальные. В данном случае речь идет о проблемах, не связанных с . Это могут быть тяжелые аритмии, сердечная недостаточность, коллапс или же снижение объема крови после обильной кровопотери.
- Ренальные причины напрямую . Возникают из-за токсических отравлений ядами, вызывающих масштабный некроз почечных канальцев, а также хроническим и , пиелонефритом и другими заболеваниями. Большую роль в данной этиологической группе играют инфекционные агенты.
- Постренальные предпосылки почечной недостаточности проявляются в виде закупорки мочеточников при мочекаменной болезни (чаще двусторонние).
Следует отметить, что у детей различного возраста заболевание имеет разную природу.
Острая почечная недостаточность является многофазным заболеванием, а именно, выделяют 4 стадии.
- Стадия первая, симптомы которой могут быть различными. Во всех случаях наблюдается снижение количества мочи.
- Вторая стадия характеризуется очень малым количеством мочи или полным ее отсутствием и поэтому обозначается как . Эта стадия может оказаться заключительной в случае отсутствия срочного медицинского вмешательства.
- На следующей, третьей, стадии происходит восстановления количества мочи (кроме того, отмечаются случаи, когда суточный объем выходит за привычные рамки). Иначе данный этап называется полиурический или восстановительный. Пока что моча состоит преимущественно из воды и растворенных в ней солей, и не способна выводить токсичные для организма вещества. На третьей стадии острой почечной недостаточности сохраняется опасность для жизни больного.
- В течение 2-3 месяцев выделительная функция почек нормализуется и человек возвращается к прежней жизни.
Клинические проявления
Острая почечная недостаточность имеет специфические и неспецифические симптомы.
К специфическим относятся олигоурия и анурия.
К неспецифическим:
- Отсутствие аппетита;
- Жидкий стул;
- Отеки конечностей;
- Тошнота и рвота;
- Заторможенность или возбужденность человека;
- Увеличение размеров печени.
Диагностика
- Клиническая картина (олигоурия, анурия);
- Показатели калия, креатинина и мочевины в крови;
- Ультразвуковое исследование, рентгенологические и радионуклидные методы.
Лечение острой почечной недостаточности
Лечение острой почечной недостаточности осуществляется в урологических стационарах. Лечебные мероприятия направлены в первую очередь на причины заболевания, выясненные через анамнез больного, а также, основывается на показателях крови пациента и клинических симптомах.
Таким образом, врачебное вмешательство направлено на устранение токсикоза, коллапса, сердечной недостаточности, гемолиза и обезвоживания больного.
В реанимационных отделениях, куда часто попадают больные, проводят или перитонеальный диализ.
Хроническая почечная недостаточность
При хронической почечной недостаточности снижение количества суточной мочи происходит постепенно. Функциональная ткань почки заменяется на соединительную вследствие долговременных хронических воспалительных процессов, при этом сама почка приобретает сморщенный внешний вид.
Причины
- Заболевания почек и поражение клубочкового аппарата: и пиелонефрит.
- Болезни, связанные с нарушением обмена веществ: сахарный диабет, подагра.
- Наследственные и врожденные почечные заболевания, связанные с анатомическими нарушениями проводимости почечной системы.
- Артериальная гипертензия и другие заболевания сосудов.
- Мочекаменная болезнь и другие причины, препятствующие свободному выведению мочи.
Первые четыре места среди всех указанных причин занимают:
- Врожденные почечные аномалии;
- Сахарный диабет;
- Пиелонефрит.
Именно эти причины являются наиболее частыми вестниками хронической почечной недостаточности.
Заболевание имеет стадийный характер. Выделяют 4 стадии:
- Латентная стадия (хроническая болезнь почек 1) является самой первой, скрытой. Среди жалоб можно выделить лишь повышенную утомляемость к концу рабочего дня, сухость во рту. При анализе крови у таких больных обнаруживают умеренный электролитный сдвиг и присутствие белка в моче.
- Компенсированная стадия (хроническая болезнь почек 2) сопровождается такими же жалобами, как и в предыдущем случае. Кроме этого, может наблюдаться увеличение объема суточной мочи до 2.5 литров (как мы знаем, в норме суточный объем мочи составляет 1.5-2.0 литра). Биохимические показатели изменяются в худшую сторону.
- Интермиттирующая стадия (азотемическая) проявляется замедлением работы почек. Данное явление сопровождается следующими признаками:
— Повышенный уровень азотистых соединений в крови;
— В моче наблюдается высокая концентрация креатинина и мочевины;
— общая слабость, быстрая утомляемость и сухость во рту, снижение аппетита и тошнота, возможна рвота.
- Терминальная стадия, приводящая к следующим признакам: повышенная дневная сонливость, эмоциональная неуравновешенность, заторможенность, нарушения сна в ночное время.
Клинические проявления хронической почечной недостаточности
Рассмотрим подробно процессы, которые происходят на каждой из стадий заболевания.
На первой стадии могут наблюдаться боли в пояснице, отеки и повышение артериального давления. В ночные часы наблюдается бессонница и частое мочеиспускание. Часть клубочков погибает, оставшаяся же часть начинает компенсировать дисфункцию погибших, изнуряя себя, в результате чего жидкость перестает всасываться. Сниженная плотность мочи в данном случае — четкий симптом первой стадии.
На следующей стадии падает скорость клубочковой фильтрации, почки не способны более компенсировать недостающую функцию. На этом этапе можно обнаружить снижение уровня витамина Д и превышение паратгормона.
Третья стадия обнаружит себя за счет снижения синтеза ренина, вследствие чего артериальное давление будет повышенным. Кишечник частично займется функцией выведения жидкости и шлаков, которая была присуща почкам, что повлечет за собой жидкий стул со специфическим зловонным запахом. Недостаточное количество эритропоэтина приведет к анемии. Дальнейшее снижение концентрации витамина Д повлечет за собой дефицит кальция и, как следствие, остеопороз. Кроме этого, при поздней азотемической стадии, нарушается липидный обмен: активируется синтез триглицеридов и холестерина, повышающих риск сосудистых осложнений.
Дефицит калия приводит к нарушению сердечного ритма. Увеличение слюнных желез придает лицу одутловатую форму, изо рта пахнет аммиаком.
Таким образом, больной хронической почечной недостаточностью выглядит характерно своему диагнозу:
- Одутловатое лицо;
- Ломкие, тускловатые волосы, серо-желтый цвет кожи;
- Срыгивания, запах аммиака изо рта;
- Вздутие живота и понос темного цвета, имеющий зловонный запах;
- Гипотермия с нарастающей дистрофией;
- Кожный зуд.
Болезнь поражает весь организм, приводит к атрофии сердечной мышцы, перикардиту, отеку легких, энцефалопатии, снижению иммунитета со всеми вытекающими последствиями. Плотности мочи и крови становятся равными, в результате чего всасывание веществ невозможно.
Приведенные выше изменения проявляются на последних стадиях заболевания и несут необратимый характер. Прогноз в данном случае крайне печален — смерть больного, которая наступает на на 4-й стадии заболевания вследствие сепсиса, уремической комы и нарушения гемодинамики.
Лечение
Своевременно начатое лечение приводит к выздоровлению пациента. Жизнь пациентов, переживающих терминальную стадию заболевания, зависит от аппарата гемодиализа. В остальных случаях помощь можно оказать медикаментозно или разовыми процедурами гемодиализа.