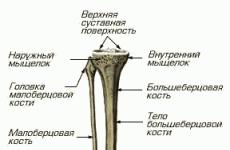
Скорость утилизации глюкозы у детей. Протокол парентерального питания в практике отделения интенсивной терапии новорожденных. Расчет скорости введения основного раствора
catad_tema Неонатология - статьи Комментарии Опубликовано в журнале: Вестник Интенсивной Терапии, 2006.
Лекция для практических врачей Е.Н. Байбарина, А.Г. Антонов
ГУ Научный Центр акушерства, гинекологии и перинатологии (директор - академик РАМН, профессор В.И.Кулаков), РАМН. Москва
Парентеральное питание (ПП) новорожденных применяется в нашей стране уже более двадцати лет, за это время накоплено много данных как по теоретическим, так и по практическим аспектам его использования. Хотя в мире активно разрабатываются и производятся препараты для ПП, доступные в нашей стране, используется этот метод питания у новорожденных недостаточно широко и не всегда адекватно.
Развитие и совершенствование методов реанимационно-интенсивной помощи, внедрение сурфактантной терапии, высокочастотной вентиляции легких, заместительной терапии внутривенными иммуноглобулинами существенно улучшили выживаемость детей с очень низкой и экстремально низкой массой тела. Так, по данным НЦ АГиП РАМН за 2005г выживаемость недоношенных детей массой 500-749г составила 12,5%; 750-999г - 66,7%; 1000-1249г - 84,6%; 1250-1499г - 92,7%. Улучшение выживаемости глубоконедоношенных невозможно без широкого и грамотного использования парентерального питания, полного понимания врачами путей метаболизма субстратов ПП, умения правильно рассчитать дозы препаратов, прогнозировать и профилактировать возможные осложнения.
I . ПУТИ МЕТАБОЛИЗМА СУБСТРАТОВ ПП
Цель проведения ПП - обеспечение белковосинтетических процессов, для которых, как видно из схемы на рис.1, требуются аминокислоты и энергия. Поставка энергии осуществляется введением углеводов и жиров, причем, как будет сказано ниже, соотношение этих субстратов может быть различным. Путь метаболизма аминокислот может быть двояким - аминокислоты могут потребляться для осуществления белковосинтетических процессов (что благоприятно) или, в условиях дефицита энергии, вступать в процесс глюконеогенеза с образованием мочевины (что неблагоприятно). Конечно, в организме все указанные превращения аминокислот происходят одновременно, но преобладающий путь может быть различным. Так, в эксперименте на крысах было показано, что в условиях избыточного поступления белка и недостаточного - энергии 57% полученных аминокислот окисляется до мочевины. Для поддержания достаточной анаболической эффективности ПП на каждый грамм аминокислот следует вводить не менее 30 небелковых килокалорий.
II. ОЦЕНКА ЭФФЕКТИВНОСТИ ПП
Оценка эффективности ПП при критических состояниях у новорожденных непроста. Такие классические критерии, как прибавка массы тела и увеличение толщины кожной складки в острых ситуациях отражают в основном динамику водного обмена. При отсутствии патологии со стороны почек возможно использование метода оценки инкремента мочевины, который основан на том, что если молекула аминокислоты не вступает в синтез белка, то про исходит ее распад с образованием молекулы мочевины. Разница концентрации мочевины до и после введения аминокислот называется инкрементом. Чем он ниже (вплоть до отрицательных величин), тем выше эффективность ПП.
Классический метод определения баланса азота крайне трудоемок и вряд ли применим в широкой клинической практике. Mы пользуемся приблизительным расчетом баланса азота исходя из того, что 65% выделяемого детьми азота приходится на азот мочевины мочи. Результаты применения этой методики хорошо коррелируют с другими клиническими и биохимическими показателями и позволяют контролировать адекватность проводимой терапии.
III. ПРЕПАРАТЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Источники аминокислот. Современными препаратами этого класса являются растворы кристаллических аминокислот (РКА). Гидролизаты белка обладают многими недостатками (несбалансированность аминокислотного состава, наличие балластных веществ) и в неонатологии уже не используются. Наиболее известными препаратами этого класса являются Вамин 18, Аминостерил КЕ 10% (Fresenius Kabi), Мориамин-5-2 (Руссель Морисита). Состав РКА постоянно совершенствуется. Теперь, кроме препаратов общего назначения создаются так называемые препараты направленного действия, способствующие не только оптимальному усвоению аминокислот при определенных клинических состояниях (почечная и печеночная недостаточность, гиперкатаболические состояния), но и ликвидации присущих этим состояниям видов дисбаланса аминокислот.
Одним из направлений в создании препаратов направленного действия является разработка специальных препаратов для новорожденных и грудных детей, в основу которых положен аминокислотный состав женского молока. Специфика его состава заключается в высоком содержании незаменимых аминокислот (около 50%), цистеина, тирозина и пролина, в то время, как фенилаланин и глицин представлены в незначительном количестве. В последнее время необходимым считается введение в состав РКА для детей таурина, биосинтез которого из метионина и цистеина у новорожденных снижен. Таурин (2-аминоэтансульфоновая кислота) для новорожденных является незаменимой АК. Таурин участвует в нескольких важных физиологических процессах, в том числе в регуляции входящего кальциевого тока и возбудимости нейронов, детоксикации, стабилизации мембран и регуляции осмотического давления. Таурин участвует в синтезе желчных кислот. Таурин предотвращает или устраняет холестаз и предотвращает развитие дегенерации сетчатки, (развивается при дефиците таурина у детей). Наиболее известны следующие препараты для парентерального питания грудных детей: Аминовен Инфант (Fresenius Kabi), Ваминолакт (в 2004 г прекращен ввоз в РФ). Есть мнение о том, что в состав РКА для детей не следует вводить глютаминовую кислоту (не путать с глутамином!), поскольку вызываемое ею увеличение содержания натрия и воды в глиальных клетках неблагоприятно при острой церебральной патологии. Есть сообщения об эффективности введения глутамина при парентеральном питании новорожденных.
Концентрация аминокислот в препаратах обычно составляет от 5 до 10%, при полном парентеральном питании доза аминокислот (сухого вещества!) составляет 2-2,5г/кг.
Источники энергии. К препаратам этой группы относятся глюкоза и жировые эмульсии. Энергетическая ценность 1г глюкозы составляет 4 ккал. 1г жира примерно 9-10 ккал. Наиболее известными жировыми эмульсиями являются Интралипид (Fresenius Kabi), Липофундин (B.Braun), Липовеноз (Fresenius Kabi), Доля энергии, поставляемой углеводами и жирами, может быть различной. Применение жировых эмульсий обеспечивает организм полиненасыщенными жирными кислотами, способствует защите стенки вен от раздражения гиперосмолярными растворами. Таким образом, применение сбалансированного ПП следует считать предпочтительным, однако при отсутствии жировых эмульсий возможно обеспечить ребенка необходимо энергией только за счет глюкозы. По классическим схемам ПП за счет глюкозы дети получают 60-70% небелкового энергообеспечения, за счет жира 30-40%. При введении жиров в меньших пропорциях задержка белка в организме новорожденных уменьшается.
IV. ДОЗИРОВКИ ПРЕПАРАТОВ ДЛЯ ПП
При проведении полного ПП новорожденным старше 7 дней доза аминокислот должна составлять 2-2,5г/кг, жира - 2-4 г/кг глюкозы - 12-15г/кг в сутки. При этом энергетическое обеспечение составит до 80-110 ккал/кг. К указанным дозировкам надо приходить постепенно, увеличивая количество вводимых препаратов в соответствии с их переносимостью, соблюдая при этом необходимую пропорцию между пластическими и энергетическими субстратам (см.алгоритм составления программ ПП).
Примерная суточная потребность в энергии составляет:
V. АЛГОРИТМ СОСТАВЛЕНИЯ ПРОГРАММЫ ПП
1. Расчет общего объема жидкости, необходимой ребенку на сутки
2. Решение вопроса о применении препаратов для инфузионной терапии специального назначения (препараты волемического действия, внутривенные иммуноглобулины и др.) и их объеме.
3. Расчет количества концентрированных растворов электролитов/витаминов/микроэлементов, необходимых ребенку, исходя из физиологической суточной потребности и величины выявленного дефицита. Рекомендуемая доза комплекса водорастворимых витаминов для внутривенного введения (Солувит Н, Fresenius Kabi) составляет 1мл/кг (при разведении в 10мл), доза комплекса жирорастворимых витаминов (Виталипид Детский, Fresenius Kabi) - 4мл/кг в сутки.
4. Определение объема раствора аминокислот, исходя из следующего приблизительного расчета: - При назначении общего объема жидкости 40-60мл/кг - 0,6г/кг аминокислот. - При назначении общего объема жидкости 85-100мл/кг - 1,5г/кг аминокислот
При назначении общего объема жидкости 125-150мл/кг - 2-2,5г/кг аминокислот.
5. Определение объема жировой эмульсии. В начале применения ее доза составляет 0,5г/кг, затем повышается до 2- 2,5г/кг
6. Определение объема раствора глюкозы. Для этого из объема, полученного в п.1 вычесть объемы, полученные в ПП.2-5. В первые сутки ПП назначают 10% раствор глюкозы, на вторые 15%, с третьих суток - 20% раствор (под контролем глюкозы крови).
7. Проверка и, при необходимости, коррекция соотношений между пластическими и энергетическими субстратами. При недостаточном энергообеспечении в пересчете на 1г аминокислот следует увеличить дозу глюкозы и/или жира, либо уменьшить дозу аминокислот.
8. Распределить полученные объемы препаратов. Скорость их введения рассчитывают таким образом, чтобы общее время инфузии составляло до 24 часа в сутки.
VI. ПРИМЕРЫ СОСТАВЛЕНИЯ ПРОГРАММ ПП
Пример 1. (Смешанное ПП)
Ребенок массой 3000 г, возраст 13 суток, диагноз - внутриутробная инфекция (пневмония, энтероколит), находился на ИВЛ 12 суток, не усваивал вводимое молоко, в настоящее время кормится через зонд сцеженным грудным молоком по 20мл 8 раз в день. 1.Общий объем жидкости 150мл/кг = 450мл. С питанием получает 20 х 8 = 160мл. С питьем получает 10 х 5 = 50мл. Внутривенно должен получить 240мл 2.Введения препаратов специального назначения не планируется. 3. 3 мл 7,5% хлорида калия, 2 мл 10% глюконата кальция. 4. Доза аминокислот - 2г/кг = 6г. С молоком получает приблизительно З г. Потребность в дополнительном введении аминокислот - 3 г. При применении препарата Аминовен Инфант 6%, который содержит аминокислот 6г в 100мл, его объем составит 50 мл. 5.Жира решено вводить 1г/кг (половину дозы, применяемой при полном ПП), что при применении препарата Липовеноз 20% или Интралипид 20% (20г в 100 мл) составит 15мл. 6.Объем жидкости для введения глюкозы составляет 240-5-50-15= 170мл 7.Потребность в энергии составляет 100 ккал/кг = 300 ккал С молоком получает 112 ккал С жировой эмульсией - 30 ккал Энергодефицит 158ккал, что соответствует 40г глюкозы (исходя из того, что 1г глюкозы дает 4 ккал). Требуется введение 20% глюкозы.
8.Назначения:
Перспективой проведения парентерального питания у данного ребенка является постепенное, по мере улучшения состояния, увеличение объема энтерального питания при снижении объема парентерального.
Пример 2 (ПП ребенка с экстремально низкой массой тела).
Ребенок массой 800г, 8х суток жизни, основной диагноз: Болезнь гиалиновых мембран. Находится на ИВЛ, нативное материнское молоко усваивает в объеме, не превышающем 1мл каждые 2 часа. 1.Общий объем жидкости 150мл/кг = 120мл. С питанием получает 1 х 12 = 12мл. Внутривенно должен получить 120-12=108мл 2.Введение препаратов специального назначения - планируется введение пентаглобина в дозе 5 х 0,8 = 4мл. 3. Планируемое введение электролитов: 1мл 7,5% хлорида калия, 2мл 10% глюконата кальция. Натрий ребенок получает с физраствором для разведения лекарственных препаратов. Планируется введение Солувита Н 1мл х 0,8 = 0,8мл и Виталипида Детского 4мл х 0,8 = 3мл 4. Доза аминокислот - 2,5г/кг = 2г. При применении препарата Аминовен Инфант 10%, который содержит аминокислот 10г в 100мл его объем составит 20мл. 5.Жира решено вводить 2,5г/кг х 0,8 = 2г, что при применении препарата Липовеноз/Интралипид 20% (20г в 100 мл) составит 10мл. 6.Объем жидкости для введения глюкозы составляет 108-4-1-2-0,8-3-20-10= 67,2 ?68 мл 7.Решено вводить 15% глюкозу, что составит 10,2г. Подсчет энергообеспечения: за счет глюкозы 68мл 15% = 10,2г х 4ккал/г? 41ккал. За счет жира 2г х 10 ккал = 20ккал. За счет молока 12мл х 0,7ккал/мл = 8,4ккал. Всего 41+20+8,4 = 69,4ккал: 0,8кг = 86,8ккал/кг, что является достаточным количеством для этого возраста. Проверка энергообеспечения на 1г вводимых аминокислот: 61 ккал (за счет глюкозы и жира): 2г (аминокислот) = 30,5ккал/г, что является достаточным.
8.Назначения:
Наиболее частой проблемой ПП детей с экстремально низкой массой тела является гипергликемия, требующая введения инсулина. Поэтому при проведении им ПП следует тщательно следить за уровнем глюкозы в крови и моче (определение качественным методом глюкозы в каждой порции мочи позволяет уменьшить количество взятия крови из пальца, что очень важно для маловесных детей).
VII. ВОЗМОЖНЫЕ ОСЛОЖНЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ И ИХ ПРЕДУПРЕЖДЕНИЕ
- Неадекватный выбор дозы жидкости с последующей дегидратацией или перегрузкой жидкостью. Контроль: подсчет диуреза, взвешивание, определение ОЦК. Необходимые мероприятия: коррекция дозы жидкости, по показаниям - применение мочегонных.
- Гипо- или гипергликемия. Контроль: определение глюкозы крови и мочи. Необходимые мероприятия: коррекция концентрации и скорости вводимой глюкозы, при выраженной гипергликемии - инсулин.
- Нарастание концентрации мочевины. Необходимые мероприятия: исключить нарушение азотвыделительной функции почек, повысить дозу энергообеспечения, снизить дозу аминокислот.
- Нарушение усвоения жиров - хилезность плазмы, выявляющаяся позднее, чем через 1-2 часа после прекращения их инфузии. Контроль: визуальное определение прозрачности плазмы при определении гематокрита. Необходимые мероприятия: отмена жировой эмульсии, назначение гепарина в малых дозах (при отсутствии противопоказаний).
- Повышение активности аланиновой и аспарагановой трансаминаз, иногда сопровождающееся клиникой холестаза. Необходимые мероприятия: отмена жировой эмульсии, желчегонная терапия.
- Инфекционные осложнения, связанные с длительным стоянием катетера в центральной вене. Необходимые мероприятия: строжайшее соблюдение правил асептики и антисептики.
Хотя метод ПП к настоящему времени достаточно хорошо изучен, может длительно применяться и давать хорошие результаты, не следует забывать, что он не является физиологичным. Энтеральное питание следует вводить, когда ребенок сможет усваивать хотя-бы минимальные количества молока. Равнее введение энтеральнрго питания, преимущественно нативного материнского молока, даже если вводится по 1-3 мл за кормление, не внося существенного вклада в энергообеспечение, улучшает пассаж по ЖКТ, ускоряет процесс перевода на энтеральное питание за счет стимуляции желчеотделения, снижает частоту развития холестаза.
Следование приведённым выше методическим разработкам - позволяет успешно и эффективно проводить ПП, улучшая исходы лечения новорожденных.
Список Литературы на сайте журнала Вестник Интенсивной терапии.
medi.ru
Протокол парентерального питания в практике отделения интенсивной терапии новорожденных
КомментарииПруткин М. Е. Областная детская клиническая больница №1, г. Екатеринбург
В неонатологической литературе последних лет большое внимание уделяется вопросам нутритивной поддержки. Проведение адекватное питание критически больного новорожденного защищает его от возможных будущих осложнений и способствует адекватному росту и развитию. Внедрение современных протоколов адекватного питания в отделении неонатальной интенсивной терапии способствует улучшенному потреблению питательных веществ, росту, сокращению пребывания больного в стационаре и, следовательно, снижению стоимости лечения больного.
В настоящем обзоре мы бы хотели представить данные современных доказательных исследований и предложить стратегию нутритивной поддержки в практике отделения неонатальной интенсивной терапии.
Физиологические особенности новорожденного и адаптация к самостоятельному питанию. Внутриутробно плод получает все необходимые питательные вещества через плаценту. Плацентарный обмен нутриентов можно расценивать как сбалансированное парентеральное питание, содержащее белки, жиры, углеводы, витамины и микроэлементы. Хотелось бы напомнить, что в течение 3-го триместра беременности отмечается беспрецедентное увеличение массы тела плода. Если масса тела плода 26 недель гестации составляет около 1000 г., то в 40 недель гестации (то есть всего через 3 месяца) новорожденный ребенок весит уже около 3000 г. Таким образом, за последние 14 недель беременности плод утраивает свою массу. Именно в эти 14 недель и происходит основное накопление плодом питательных веществ, которые потребуются ему для последующей адаптации к внеутробной жизни.
Таблица 2. Физиологические особенности новорожденного
Процесс всасывания жирных кислот с длинной цепью затруднен в связи с недостаточной активностью желчных кислот.
Запасы питательных веществ. Чем более недоношенным рождается новорожденный ребенок, тем меньшим запасом питательных веществ он обладает. Сразу после рождения и пересечения пуповины поток питательных веществ, поступавший к плоду через плацентарную систему, прекращается, а высокая потребность в нутриентах остается. Следует также помнить, что в силу структурной и функциональной незрелости органов пищеварения способность недоношенных новорожденных к самостоятельному энтеральному питанию ограничена (табл. 2). Поскольку идеальной моделью роста и развития недоношенного ребенка для нас будет являться внутриутробный рост и развитие плода, наша задача – обеспечить нашему пациенту столь же сбалансированное, полноценное и адекватное питание как то, которое он получал внутриутробно.
В таблице 3 приведена оценка энергетической потребности растущего недоношенного ребенка по данным Американской академии педиатрии и Европейского общества гастроэнтерологии и питания.
Таблица 3
Особенности метаболизма питательных веществ у новорожденных
Жидкость и электролиты. В течение первой недели жизни у новорожденного ребенка происходят значительные изменения водно-электролитного обмена, которые отражают процесс его адаптации к условиям внеутробной жизни. Уменьшается общее количество жидкости в организме и происходит перераспределение жидкости между межклеточным и внутриклеточным сектором (рис. 2).
Рис. 2 Влияние возраста на распределение жидкости между секторами
Именно эти перераспределения приводят к «физиологической» убыли в массе тела, которая развивается в первую неделю жизни. Большое влияние на водно-электролитный обмен, особенно у маленьких недоношенных новорожденных могут оказывать т.н. «неощутимые потери» жидкости. Коррекция дозы жидкости проводится на основании темпа диуреза (2-5 мл/кг/ч), относительной плотности мочи (1002 – 1010) и динамики массы тела.
Натрий – основной катион внеклеточной жидкости. Примерно 80% натрия в организме метаболически доступно. Потребность в натрии обычно составляет 3 мМоль/кг/сут. У маленьких недоношенных детей вследствие незрелости канальцевой системы могут отмечаться значительные потери натрия. Эти потери могут потребовать возмещения вплоть до 7-8 мМоль/кг/сут.
Калий – основной внутриклеточный катион (примерно 75% калия находится в мышечных клетках). Концентрация калия в плазме определяется многими факторами (нарушения кислотно-основного состояния, асфиксия, инсулинотерапия) и не является достоверным показателем запасов калия в организме. Обычно потребность в калии составляет 2 мМоль/кг/сут.
Хлориды – основные анионы внеклеточной жидкости. Передозировка, как и дефицит хлоридов, может приводить к нарушению кислотно-основного состояния. Потребность в хлоридах составляет 2 – 6 мЭкв/кг/сут.
Кальций – преимущественно локализуется в костях. Примерно 60% кальция плазмы находится в связи с белком (альбумином), поэтому даже измерение биохимически активного (ионизированного) кальция не позволяет достоверно судить о запасах кальция в организме. Потребность в кальции обычно составляет 1-2 мЭкв/кг/сут.
Магний – преимущественно (60%) находится в костях. Большая часть оставшегося магния находится внутриклеточно, поэтому измерение магния в плазме не позволяет точно оценить запасы магния в организме. Однако это не означает, что не следует контролировать концентрацию магния в плазме. Обычно потребность в магнии составляет 0.5 мЭкв/кг/сут. С осторожностью следует датировать магний новорожденным, чьи матери получали терапию сульфатом магния перед родами. Для лечения упорной гипокальциемии может потребоваться увеличение дозы магния.
В течение всего периода гестации плод получает глюкозу от матери через плаценту. Уровень сахара крови плода составляет примерно 70% от сахара крови матери. В условиях нормогликемии матери плод практически не синтезирует глюкозу сам, несмотря на то, что ферменты глюконеогенеза определяются, начиная с 3-го месяца гестации. Таким образом, в случае голодания матери плод способен достаточно рано синтезировать глюкозу сам из таких продуктов, как кетоновые тела.
Гликоген начинает синтезироваться у плода с 9-й недели гестации. Интересно, что на ранних сроках гестации накопление гликогена происходит преимущественно в легких и в сердечной мышце, а затем, в течение третьего триместра беременности основные запасы гликогена образуются в печени и скелетных мышцах, а в легких исчезают. Отмечено, что выживаемость новорожденного после перенесенной асфиксии напрямую зависит от содержания гликогена в миокарде. Уменьшение содержания гликогена в легких начинается на 34-36 неделе, что может быть связано с расходом этого источника энергии на синтез сурфактанта.
На скорость накопления гликогена могут влиять такие факторы, как голодание матери, плацентарная недостаточность и многоплодная беременность. Острая асфиксия не влияет на содержание гликогена в тканях плода, в то время как хроническая гипоксия, например при преэклампсии матери, может приводить к дефициту накопления гликогена.
Инсулин является основным анаболическим гормоном плода в течение всего гестационного периода. Инсулин появляется в ткани поджелудочной железы к 8-10 неделе гестации и уровень его секреции у доношенного новорожденного соответствует таковому у взрослого человека. Поджелудочная железа плода менее чувствительна к гипергликемии. Отмечено, что повышенное содержание аминокислот делает стимуляцию выработки инсулина более эффективной. Исследования на животных показали, что в условиях гиперинсулинизма усиливается синтез белка и скорость утилизации глюкозы, в то время, как при дефиците инсулина уменьшается количество клеток и содержание в клетке ДНК . Эти данные объясняют макросомию детей от матерей с сахарным диабетом, которые в течение всего гестационного периода находятся в условиях гипергликемии и, следовательно, гиперинсулинизма. Глюкагон обнаруживается у плода, начиная с 15 недели гестации, но его роль пока остается неизученной.
После родов и прекращения поступления глюкозы через плаценту под влиянием ряда гормональных факторов (глюкагон, катехоламины) происходит активация ферментов глюконеогенез, которая обычно длится 2 недели после рождения, независимо от гестационного возраста. Независимо от пути введения (энтерально или парентерально) 1/3 глюкозы утилизируется в кишечнике и печени, до 2/3 распределяется по организму. Большая часть усвоенной глюкозы расходуется на выработку энергии
Исследования показали, что в среднем скорость продукции/утилизации глюкозы у доношенного новорожденного составляет 3.3 – 5.5 мг/кг/мин. .
Поддержание уровня глюкозы в крови зависит от уровня гликогенолиза и глюконеогенеза в печени и скорости ее утилизации на периферии.
Как уже упоминалось выше, в течение третьего триместра беременности происходит значительный рост и развитие ребенка. Поскольку идеальной моделью развития ребенка является внутриутробное развитие плода соответствующего гестационного возраста, потребность недоношенного в белке и темпы его накопления можно оценить, наблюдая за белковым обменом плода.
Если после рождения ребенка и прекращения плацентарного кровообращения не происходит адекватной дотации белка, это может привести к отрицательному азотистому балансу и потере белка. В то же время, несколько исследований продемонстрировали, что потребление белка в дозе 1 г/кг способно нивелировать отрицательный азотистый баланс, а увеличение дозы белка даже при скромной дотации энергии способно сделать азотистый баланс положительным (Табл. 6).
Таблица 6. Исследования азотистого баланса у новорожденных в течение 1-й недели жизни.
На накопление белка недоношенным новорожденным влияют различные факторы .
- Нутритивные факторы (количество аминокислот в программе питания, соотношение белок/энергия, исходный нутритивный статус)
- Физиологические факторы (соответствие гестационному возрасту, индивидуальные особенности и.т.д.)
- Эндокринные факторы (инсулиноподобный фактор роста и.т.д.)
- Патологические факторы (сепсис и другие болезненные состояния).
Усвоение белка здоровым недоношенным ребенком с гестационным возрастом 26-35 недель гестации составляет примерно 70%. Оставшиеся 30% подвергаются оксидации и экскретируются. Следует отметить, что чем меньше гестационный возраст ребенка, тем большее активный белковый обмен в пересчете на единицу массы тела наблюдается в его организме.
Поскольку синтез эндогенного белка – энергозависимый процесс, для оптимального накопления белка организмом недоношенного ребенка требуется определенное соотношение белка и энергии. В условиях энергетического дефицита эндогенные белки используются как источник энергии и
Поэтому азотистый баланс остается отрицательным. В условиях субоптимального снабжения энергией (50-90 ккал/кг/сут) увеличение дотации, как белка, так и энергии ведет к накоплению белка в организме. В условиях достаточного снабжения энергией (120 ккал/кг/сут) накопление белка стабилизируется и дальнейшее увеличение дотации белка не приводит к его дальнейшему накоплению . Оптимальным для роста и развития считается соотношение 10ккал/1 г белка. В некоторых источниках приводится соотношение 1 белковая калория/10 калорий небелкового происхождения.
Дефицит аминокислот помимо отрицательных последствий для роста и накопления белка может приводить к таким неблагоприятным последствиям, как снижение в плазме инсулиноподобного фактора роста, нарушениям деятельности клеточных транспортеров глюкозы и, следовательно, гипергликемии, гиперкалийемии и энергетическому дефициту клетки. Обмен аминокислот у новорожденных имеет ряд особенностей (табл. 7).
Таблица 7. Особенности обмена аминокислот у новорожденных
Вышеперечисленные особенности определяют необходимость использования для парентерального питания новорожденных специальные аминокислотные смеси, адаптированные к метаболическим особенностям новорожденного. Использование таких препаратов позволяет удовлетворить потребности новорожденного в аминокислотах и избежать довольно серьезных осложнений парентерального питания .
Потребность недоношенного новорожденного в белке составляет 2.5-3 г/кг.
Последние данные, полученные Thureen PJ et all. показывают, что даже раннее назначение 3 г/кг/сут аминокислот не приводило к токсическим осложнениям, зато улучшало показатели азотистого баланса.
В эксперименте на недоношенных животных показано, что положительный азотистый баланс и накопление азота у новорожденных при раннем применении аминокислот связано с усилением синтеза альбумина и белка скелетных мышц.
Принимая во внимание изложенные выше соображения, дотация белков начинается со 2-х суток жизни, если состояние ребенка к этому моменту времени стабилизировано или сразу после стабилизации показателей центральной гемодинамики и газообмена, если это происходит позже 2-х суток жизни. В качестве источника белков при проведении парентерального питания используются специально адаптированные для новорожденных растворы кристаллических аминокислот (Аминовен-Инфант, Трофамин). Неадаптированные аминокислотные препараты не должны использоваться у новорожденных.
Липиды являются необходимым субстратом для нормального функционирования организма новорожденного ребенка. Таблица демонстрирует, что жиры являются не только необходимым и выгодным источником энергии, но и необходимым субстратом для синтеза клеточных мембран и таких необходимых биологически-активных веществ, как простагландины, лекотриены и.т.д. Жирные кислоты способствуют созреванию сетчатки и головного мозга. Кроме того, следует помнить, что основной составляющей сурфактанта являются фосфолипиды
Организм доношенного новорожденного ребенка содержит от 16% до 18% белого жира. Кроме того, присутствует небольшое количество бурого жира, который необходим для продукции тепла. Основное накопление жира происходит в течение последних 12-14 недель гестации. Недоношенные дети рождаются с существенным дефицитом жиров. Кроме того, недоношенные дети не могут синтезировать некоторые необходимые жирные кислоты из доступных предшественников. Необходимые количества этих незаменимых жирных кислот содержится в грудном молоке и не содержится в смесях для искусственного вскармливания. Есть некоторые доказательства того, что добавление этих жирных кислот в смесь для кормления недоношенных новорожденных способствует ускорению созревания сетчатки, хотя не было выявлено никаких долговременных преимуществ применения таких веществ. .
Исследования последних лет свидетельствуют о том, что применение жиров (в исследовании использовался Интралипид) при парентеральном питании способствует формированию глюконеогенеза у недоношенных новорожденных.
Опубликованы данные, показывающие целесообразность внедрения в клиническую практику и использование у недоношенных новорожденных жировых эмульсий на основе оливкового масла. Эти эмульсии содержат меньше полиненасыщенных жирных кислот и больше витамина Е. Причем витамин Е в таких составах более доступен, чем в составах на основе соевого масла. Такое сочетание может иметь преимущества у подверженных окидативному стрессу новорожденных, антиоксидантная защита которых слаба.
Исследования Kao с соавторами, посвященные утилизации парентеральных жиров, показали, что усвоение жиров лимитируется не суточной дозой (например 1 г/кг/сут), а скоростью введения жировой эмульсии . Не рекомендуется превышать скорость инфузии более 0.4-0.8 г/кг/сут. Некоторые факторы (стресс, шок, хирургическая операция) могут повлиять на способность к утилизации жиров. В этом случае скорость инфузии жиров рекомендуется снизить или вовсе прекратить. Кроме того, исследования показали, что применение 20% жировых эмульсий было связано с меньшим количеством метаболических осложнений, чем использование 10% жировых эмульсий .
Скорость утилизации жиров также будет зависеть как от общих энергозатрат новорожденного, так и от дозы глюкозы, которую получает ребенок. Есть данные, что применение глюкозы в дозе более 20 г/кг/сут тормозит утилизацию жиров.
Несколько исследований были посвящены изучению взаимосвязи между содержанием в плазме свободных жирных кислот и концентрации неконьюгированного билирубина . Ни в одном из них не было обнаружено положительной корреляционной зависимости.
Противоречивыми остаются данные о влиянии жировых эмульсий на газообмен и легочное сосудистое сопротивление. Жировые эмульсии (Липовеноз, Интралипид) мы начинаем использовать с 3-х –4-х cуток жизни, если считаем, что к 7 – 10 суткам жизни ребенок не начнет усваивать 70 – 80 ккал/кг энтерально.
Витамины
Потребность недоношенных новорожденных в витаминах представлена в таблице 10 .
Таблица 10. Потребности новорожденного в водо-и жирорастворимых витаминах
Отечественная фармацевтическая промышленность выпускает достаточно большой спектр витаминных препаратов для парентерального введения. Использование этих препаратов при проведении парентерального питания у новорожденных не представляется рациональным из-за несовместимости большинства этих препаратов друг с другом в растворе и сложностях при дозировании, если исходить из потребностей, приведенных в таблице. Оптимальным представляется использование поливитаминных препаратов. На отечественном рынке водорастворимые поливитамины для парентерального введения представлены препаратом Солувит, а жирорастворимые – препаратом Виталипид.
СОЛУВИТ Н (SOLUVIT N) добавляется в раствор для парентерального питания из расчета 1 мл/кг. Может добавляться и в жировую эмульсию. Обеспечивает ребенку суточную потребность во всех водорастворимых витаминах.
Виталипид Н детский (Vitalipid N infant) – Специальный препарат, содержащий жирорастворимые витамины, для удовлетворения суточной потребности в жирорастворимых витаминах: А, Д, Е и K1. Препарат растворяется только в жировой эмульсии. Выпускается в ампулах по 10 мл
Показания для парентерального питания.
Парентеральное питание должно обеспечивать доставку питательных веществ тогда, когда энтеральное питание невозможно (атрезия пищевода, язвенно-некротический энтероколит) или его объем недостаточен для покрытия метаболических потребностей новорожденного ребенка.
В заключении хотелось бы отметить, что описанная выше методика проведения парентерального питания успешно используется в отделении реанимации новорожденных Областной детской больницы г. Екатеринбурга уже около 10 лет. Для ускорения и оптимизации расчетов разработана компьютерная программа. Использование данного алгоритма позволило оптимизировать применение дорогостоящих препаратов для парентерального питания, свести к минимуму частоту возможных осложнений и оптимизировать применение препаратов крови.
Список литературы: на сайте в интернете vestvit.ru
Комментарии (видны только специалистам, верифицированным редакцией МЕДИ РУ) Если Вы медицинский специалист, войдите или зарегистрируйтесь
medi.ru
ПРОТОКОЛ ИНФУЗ.ТЕРАПИИ У НОВОРОЖД
ГОУ ВПО Санкт-Петербургскаягосударственная педиатрическая медицинская академия Минздравсоцразвития России
Мостовой А.В., Пруткин М.Е., Горелик К.Д., Карпова А.Л.
ПРОТОКОЛ ИНФУЗИОННОЙ ТЕРАПИИ И ПАРЕНТЕРАЛЬНОГО
ПИТАНИЯ НОВОРОЖДЕННЫХ
Рецензенты:
Проф. Александрович Ю.С. Проф. Гордеев В.И.
Санкт-Петербург
А.В. Мостовой1, 4, М.Е. Пруткин2, К.Д. Горелик4, А.Л. Карпова3.
1Санкт-Петербургскаягосударственная педиатрическая медицинская академия
2Областная детская больница, г. Екатеринбург
3Областной родильный дом, г. Ярославль
4Детская городская больница №1, Санкт-Петербург
Цель создания протокола: унифицировать подходы к организации инфузионной терапии и парентерального питания для новорожденных детей с различной перинатальной патологией, которые покаким-либопричинам не получают энтеральное питание в должном объеме в данный возрастной период (объем фактического энтерального питания менее 75% от долженствующего).
Основная задача организации парентерального питания у новорожденного ребенка с тяжелой перинатальной патологией заключается в имитации (создании модели) внутриутробного поступления нутриентов.
Концепция раннего парентерального питания:
основная задача – дотация необходимого количества аминокислот
обеспечение энергии путем наиболее раннего введения жиров
введение глюкозы с учетом особенностей ее внутриутробного поступления.
Некоторые особенности внутриутробного поступления питательных веществ:
Внутриутробно аминокислоты поступают к плоду в объеме 3,5 – 4,0 г/кг/сутки (больше, чем он может усвоить)
Избыток аминокислот у плода окисляется и служит источником энергии
Скорость поступления глюкозы у плода в пределах 6 – 10 мг/кг/мин.
Предпосылки для проведения раннего парентерального питания:
аминокислоты и жировые эмульсии должны поступать в организм ребенка начиная с первых суток жизни (B)
потери белка обратно пропорциональны гестационному возрасту
у новорожденных с экстремально низкой массой тела (ЭНМТ) потери в 2 раза превышают таковые в сравнении с доношенными новорожденными
у новорожденных с ЭНМТ потери белка от общего депо составляют 1-2%в день, если они не получают аминокислот внутривенно
задержка дотации белка в первую неделю жизни приводит к возрастанию белкового дефицита до 25% от общего содержания в организме недоношенного с ЭНМТ
случаи гиперкалийемии могут быть сокращены при условии дотации в программе парентерального питания аминокислот в дозе не менее 1 г/кг/сутки, начиная с первого дня жизни у недоношенных детей с массой тела менее 1500 граммов (II)
введение аминокислот внутривенно может поддержать белковый баланс и улучшить усвоение белка
раннее введение аминокислот безопасно и эффективно
раннее введение аминокислот способствует лучшему росту и развитию
максимальное парентеральное поступление аминокислот должно быть в пределах от 2 и максимально до 4 г/кг/сутки у недоношенных и доношенных новорожденных (B)
максимальное поступление липидов не должно превышать 3 – 4 г/кг/сутки у недоношенных и доношенных новорожденных (B)
ограничение поступления жидкости с ограничением поступления хлорида натрия может уменьшить потребность в проведении искусственной вентиляции легких

_____________________
* А - высококачественные мета-анализыили РКИ, а также РКИ с достаточной силой, выполненные на «целевой популяции» пациентов.
B - мета - анализы или рандомизированные контролируемые исследования (РКИ) или высококачественные обзоры исследований с контролем случаев (case-controlstudies) или низкая степень РКИ, но с высокой чувствительностью по отношению к контрольной группе.
С - хорошо собранные случаи или когортные исследования с низким риском ошибки.
D - доказательства, полученные из небольших исследований, описаний случаев, мнения экспертов.
Принципы организации парентерального питания:
Необходимо полное понимание путей метаболизма субстратов парентерального питания
Необходимо умение правильно рассчитывать дозы препаратов
Необходимо обеспечить адекватный венозный доступ (как правило, центральный венозный катетер: пупочный, глубокая линия и др.; реже периферический). Использование периферического венозного доступа возможно в 1-2сутки жизни у новорожденных с ЭНМТ и ОНМТ при условии, что процент глюкозы в базовой инфузионной программе (приготовленном растворе парентерального питания) будет менее 12,5%
Знать особенности оборудования и расходных материалов, используемых для проведения инфузионной терапии и парентерального питания
Необходимо знать о возможных осложнениях, уметь их прогнозировать и предупреждать.
АЛГОРИТМ РАСЧЕТА ИНФУЗИОННОЙ ТЕРАПИИ И ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
I.Расчет общего количества жидкости на сутки
III. Расчет необходимого объема электролитов
IV. Расчет объема жировой эмульсии
V.Расчет дозы аминокислот
VI. Расчет дозы глюкозы, исходя из скорости утилизации VII. Определение объема, приходящегося на глюкозу
VIII. Подбор необходимого объема глюкозы различных концентраций IX. Инфузионная программа, расчет скорости инфузии растворов и
концентрации глюкозы в инфузионном растворе
X.Определение и расчет итогового суточного количества калорий.
I.Расчет общего количества жидкости
1.Всем новорожденным детям, нуждающимся в проведении инфузионной терапии и/или парентерального питания, необходимо определить общий объем вводимой жидкости. Однако прежде чем приступить к расчету объема инфузии и/или парентерального питания, необходимо ответить на следующие вопросы:
a. Есть ли у ребенка признаки артериальной гипотензии?
Основные признаки артериальной гипотензии, на которые необходимо обратить внимание: нарушение периферической перфузии тканей (бледная кожа, при растирании розовеет, симптом «белого пятна» более 3 секунд, снижение темпа диуреза), тахикардия, слабая пульсация на периферических артериях, наличие частично компенсированного метаболического ацидоза
b. Есть ли у ребенка признаки шока?
Основные признаки шока: признаки дыхательной недостаточности (апноэ, снижение сатурации, раздувание крыльев носа, тахипноэ, втяжение уступчивых мест грудной клетки, брадипноэ, увеличение работы дыхания). Нарушение периферической перфузии тканей (бледная кожа, при растирании розовеет, симптом «белого пятна» более 3 секунд, холодные конечности). Расстройства центральной гемодинамики (тахикардия или брадикардия, низкое АД), метаболический ацидоз, снижение диуреза (в течение первых 6- 12 часов менее 0,5 мл/кг/час, в возрасте более 24 часов менее 1,0 мл/кг/час). Нарушение сознания (апноэ, вялость, снижение мышечного тонуса, сонливость, и др.).
2.Если Вы отвечаете на один из поставленных вопросов положительно, необходимо начинать терапию артериальной гипотензии или шока, используя соответствующие протоколы и только после стабилизации состояния, восстановления тканевой перфузии и нормализации оксигенации можно начинать парентеральное введение нутриентов.
3.Если на вопросы Вы можете твердо ответить «Нет», начинайте традиционный расчет парентерального питания, используя данный протокол.
4.В таблице №1 представлен упрощенный подход к определению суточной потребности в жидкости для недоношенных новорожденных, помещенных в инкубатор с адекватным увлажнением окружающей ребенка среды и термонейтральной окружающей средой:
Таблица 1
Потребность в жидкости новорожденных, выхаживаемых в условиях инкубатора (мл/кг/сут)
Возраст, сутки | Масса тела, г. | ||||
5.Если ребенок достиг третьих суток жизни или так называемой «переходной фазы», можно ориентироваться на приведенные ниже значения (таблица №2). Переходная фаза заканчивается тогда, когда темп диуреза стабилизируется на уровне 1 мл/кг/час, относительная плотность мочи становится > 1012 и снижается уровень экскреции натрия:

*- если ребенок находится в инкубаторе, потребность снижается на 10-20%
**- для одновалентных ионов 1 мЭкв = 1 ммоль
6.В таблице №3 представлены рекомендуемые значения физиологической потребности в жидкости для новорожденных в возрасте до двух недель жизни (так называемая фаза стабилизации). Для недоношенных детей актуально увеличение экскреции натрия, на фоне развития полиурии. Также в этот период актуально расширение объема энтерального питания, поэтому данный возраст требует от врача особенного внимания при расчете общего объема жидкости и нутриентов
КЛИНИЧЕСКИЙ ПРИМЕР:
Ребенок 3-хсуток жизни, вес – 1200 г при рождении Долженствующий объем инфузии на сутки = Суточная потребность в жидкости (СПЖ) × масса тела (кг)
СПЖ = 100 мл/кг Долженствующий объем инфузии на сутки = 120 мл × 1,2 = 120 мл
Ответ: общий объем жидкости (инфузионная терапия + парентеральное питание
Энтеральное питание) = 120 мл в сутки
II.Расчет энтерального питания
Втаблице №4 представлены данные об энергетической ценности, составе и осмолярности некоторых молочных смесей в сравнении с усредненным составом женского грудного молока. Эти данные необходимы для точного расчета нутриентов новорожденным при смешанном энтеральном и парентеральном питании
Таблица 4 |
|||||
Состав женского грудного молока и молочных смесей | |||||
Молоко/смесь | Углеводы | Осмолярность, |
|||
Грудное молоко зрелое | |||||
(срочные роды) | |||||
Нутрилон | |||||
Энфамил Премиум 1 | |||||
Грудное молоко | |||||
(преждевременные роды) | |||||
Нутрилон Пепти ТСЦ | |||||
Пре-Нутрилон | |||||
Similac Neo Sure | |||||
Similac Special Care | |||||
Фрисопре | |||||
Прегестимил | |||||
Enfamil Premature | |||||
Энергетические потребности новорожденных:
Энергетические потребности новорожденных зависят от различных факторов: гестационный и постнатальный возраст, масса тела, путь поступления энергии, скорость роста, активность ребенка и теплопотери, определяемые окружающей средой. Больные дети, а также новорожденные, находящиеся в серьезных стрессовых ситуациях (сепсис, БЛД, хирургическая патология), нуждаются в увеличении поступления энергии в организм
Белок не является идеальным источником энергии, он предназначен для синтеза новых тканей. Когда ребенок получает адекватное количество небелковых калорий, у него сохраняется положительный азотистый баланс. Часть белка в этом случае расходуется на синтетические цели. Следовательно, нельзя учитывать все калории от вводимого белка, так как часть его будет недоступна для покрытия энергетических потребностей, и будет использоваться организмом с пластической целью.
Идеальное соотношение поступающей энергии: 65% за счет углеводов и 35% за счет жировых эмульсий. В основном, начиная со второй недели жизни, дети с нормальной скоростью роста нуждаются в 100 – 120 ккал/кг/сутки, и лишь в редких случаях потребности могут значительно возрастать, например, у больных БЛД до 160 – 180 ккал/кг/сутки
Таблица 5
Энергетические потребности новорожденных детей в раннем неонатальном периоде
Ккал/кг/сутки | |||||||
Физическая активность (+30% от потребности на основной обмен) | |||||||
Тепловые потери (терморегуляция) | |||||||
Специфическое динамическое действие пищи | |||||||
Потери со стулом (10% от поступающей) | |||||||
Рост (энергетические запасы) | |||||||
Общие затраты | |||||||
Потребности в энергии на основной обмен (в состоянии покоя) составляют 49 – 60 | |||||||
ккал/кг/сутки в возрасте от 8 до 63 дня жизни (Sinclair, 1978) | |||||||
Для недоношенного ребенка, находящегося на полном энтеральном |
|||||||
вскармливании, расчет поступающей энергии будет отличаться (таблица №6) | |||||||
Таблица 6 |
|||||||
Общая потребность в энергии на фоне прибавки в весе по 10 – 15 г/сутки* |
|||||||
Энергетические затраты в сутки | Ккал/кг/сутки | ||||||
Расход энергии в покое (основной обмен) | |||||||
Минимальная физическая активность | |||||||
Возможный холодовой стресс | |||||||
Потери со стулом (10 – 15% от поступающей энергии) | |||||||
Рост (4,5 ккал/грамм) | |||||||
Общие потребности | |||||||
* По Данным N Ambalavanan, 2010 |
Потребность в энергии у детей раннего неонатального периода распределяется неравномерно. В таблице №7 представлено примерное количество калорий в зависимости от возраста ребенка:
На первой неделе жизни оптимальное снабжение энергией должно быть в пределах - 50-90 ккал/кг/сутки. Достаточное снабжение энергией к 7 дню жизни у доношенных новорожденных должно составлять -120 ккал/кг/сутки. Когда проводится парентеральное питание у недоношенных новорожденных, потребность в энергии меньшеиз-заотсутствия потерь со стулом, отсутствия эпизодов перегрева или холодового стресса, и меньшей физической активности. Таким образом, общие энергетические

потребности при проведении парентерального питания могут составлять примерно80 –
100 ккал/кг/сутки .
Калорийный метод расчета питания для недоношенных новорожденных
КЛИНИЧЕСКИЙ ПРИМЕР:
Масса тела пациента – 1,2 кг Возраст – 3 сутки жизни Молочная смесь – Пре-Нутрилон
*где 8 – число кормлений в сутки
Минимальное трофическое питание (МТП). Минимальное трофическое питание определяется как объем питания, получаемый ребенком энтерально в количестве ≤ 20 мл/кг/сутки. Преимущества МТП:
Ускоряет созревание моторной и других функций желудочно-кишечноготракта (ЖКТ)
Улучшает переносимость энтерального питания
Ускоряет время достижения полного объема энтерального питания
Не увеличивает (по некоторым данным уменьшает) частоту НЭК
Уменьшает длительность госпитализации.
Ребенок усваивает смесь «Пре-Нутрилон»по 1,5 мл каждые 3 часа
Энтеральный фактический объем питания за сутки (мл) = Объем разового кормления (мл) x Число кормлений
Энтеральный объем питания за сутки = 1,5 мл x 8 кормлений = 12 мл/сутки
Расчет количества нутриентов и калорий, которые ребенок получит за сутки энтерально:
Углеводов энтерально = 12 мл x 8,2 / 100 = 0,98 г Белка энтерально = 12 мл x 2,2 / 100 =0,26 г Жиров энтерально = 12 мл x 4,4 / 100 =0,53 г
Калорий энтерально = 12 мл x 80 /100 = 9,6 ккал

III.Расчет необходимого объема электролитов
Введение натрия и калия целесообразно начинать не ранее третьих суток жизни, кальция
– с первых суток жизни.
1.РАСЧЕТ ДОЗЫ НАТРИЯ
Потребность в натрии составляет 2 ммоль/кг/сутки
Гипонатрийемия 150 ммоль/л, опасно > 155 ммоль/л
1 ммоль (мЭкв) натрия содержится в 0,58 мл 10% NaCl
1 ммоль (мЭкв) натрия содержится в 6,7 мл 0,9% NaCl
1 мл 0,9% (физиологического) раствора хлорида натрия содержит 0,15 ммоль Na
Клинический пример (продолжение)
Возраст – 3 сутки жизни, масса тела – 1,2 кг, потребность в натрии – 1,0 ммоль/кг/сутки
V физиологического раствора = 1,2 × 1,0 / 0,15 = 8,0 мл
КОРРЕКЦИЯ ГИПОНАТРИЕМИИ (Na
Объем 10% NaCl (мл) = (135 - Na больного) × m тела × 0.175
2.РАСЧЕТ ДОЗЫ КАЛИЯ
Потребность в калии составляет 2 – 3 ммоль/кг/сутки
Гипокалийемия
Гиперкалийемия > 6,0 ммоль/л (при отсутствии гемолиза), опасно > 6,5 ммоль/л (или если на ЭКГ имеются патологические изменения)
1 ммоль (мЭкв) калия содержится в 1 мл 7,5% KCl
1 ммоль (мЭкв) калия содержится в 1,8 мл 4% KCl
V (мл 4% КCl) = потребность в К+ (ммоль) × mтела × 2
Клинический пример (продолжение)
Возраст – 3 сутки жизни, масса тела – 1,2 кг, потребность в калии – 1,0 ммоль/кг/сутки
V 4% КCl (мл) = 1,0 × 1,2× 2,0 = 2,4 мл
* Влияние уровня pH на K+: изменения pH на 0,1 → изменят9 K+ на0,3-0,6ммоль/л (Много кислоты, больше K+; Мало кислоты, меньше K+)

III. РАСЧЕТ ДОЗЫ КАЛЬЦИЯ
Потребность в Са++ у новорожденных составляет1-2ммоль/кг/сутки
Гипокальцийемия
Гиперкальцийемия > 1,25 ммоль/л (ионизированный Са++)
1 мл 10% хлорида кальция содержит 0,9 ммоль Са++
1 мл 10% глюконата кальция содержит 0,3 ммоль Са++
Клинический пример (продолжение)
Возраст – 3 сутки жизни, масса тела – 1,2 кг, потребность в кальции – 1,0 ммоль/кг/сутки
V 10% СаCl2 (мл) = 1 × 1,2 × 1,1*=1,3 мл
*- коэффициент расчета для 10% хлорида кальция составляет 1,1, для 10% глюконата кальция – 3,3
4.РАСЧЕТ ДОЗЫ МАГНИЯ:
Потребность в магнии составляет 0,5 ммоль/кг/сут
Гипомагнийемия 1,5 ммоль/л
1 мл 25% магния сульфата содержит 2 ммоль магния
Клинический пример (продолжение)
Возраст – 3 сутки жизни, масса тела – 1,2 кг, потребность в магнии – 0,5 ммоль/кг/сутки
V 25% MgSO4 (мл)= 0,5 × 1,2/ 2= 0,3 мл
Хотя вопросы парентерального питания (ПП) новорожденных начали широко изучать еще в семидесятых годах, в мире активно разрабатываются и производятся препараты для ПП, доступные в нашей стране, применяется этот метод лечения у новорожденных неоправданно редко. Это связано с существованием нескольких мифов, касающихся вопросов применения ПП у новорожденных и, в особенности недоношенных детей.
Первый из них - ПП можно не применять у новорожденных, которые в состоянии усваивать хотя бы небольшое количество молока и получают внутривенно глюкозу и препараты цельного белка (плазма, альбумин).
Второй заключается в убеждении, что применение ПП чревато серьезными осложнениями, риск возникновения которых выше, чем риск проявления неблагоприятных последствий частичного голодания.
На самом деле эффект частичного голодания хотя и не может быть легко выделен из сложного комплекса патологических проявлений, характерных для тяжелобольного новорожденного, он является фоном, во многом определяющим течение основного заболевания, частоту возникновения ос-ложнений и, соответственно - исход. Ведь синтез белка обуславливает и течение репаративных процессов, и синтез антител, и нормальное течение метаболических процессов на клеточном уровне, не говоря уже о росте и развитии детского организма.
Несмотря на то, что перечень возможных осложнений ПП велик, возникают они нечасто и в своем большинстве носят легкоустранимый характер.
Исходя из вышеизложенного, считаем, что парентеральное питание должно шире использо-ваться у тех новорожденных, которые по каким-либо причинам не получают перорального питания совсем или получают его в ограниченном количестве (энтероколит, парез или дискинезия желудочно-кишечного тракта, состояние после хирургической коррекции заболеваний кишечника, крайняя незрелость пищеварительной системы у детей с экстремально низкой массой тела). По данным отделе-ния реанимации новорожденных НЦ АГП РАМН, среди детей, масса тела которых ниже 1000 г в про-ведении ПП нуждались 100%, при массе тела от 1000 до 1499 г -92%, при массе от 1500 до 2000 г - 53%, при массе более 2000 г -38%. Однако широкое проведение ПП возможно только при условии полного понимания врачами путей метаболизма субстратов ПП, умения правильно рассчитать дозы препаратов, прогнозировать и профилактировать возможные осложнения.
б. Источники энергии
К препаратам этой группы относятся глюкоза и жировые эмульсии. Энергетическая ценность 1 г глюкозы составляет 4 ккал, 1 г жира примерно 10 ккал. Наиболее известными жировыми эмульсиями являются Интралипид (Рhагmасiа), Липофундин МСТ (В.Вгаun), Липовеноз (Fгеsenius).
Как видно из Рис. 1, доля энергии, поставляемой углеводами и жирами, может быть различной. На этом основано существование двух методов ПП - так называемого липидного метода (скандинавский метод, метод сбалансированного ПП) и глюкозный (метод гипералиментации по Dudriск). Разни-ца между этими методами заключается в используемых энергетических субстратах - при применении липидного метода используются глюкоза и жировые эмульсии, а при использовании метода гиперали-ментации - только глюкоза. Понятно, что для обеспечения равноценной калорийности при системе ги-пералиментации приходится использовать значительно большие количества глюкозы, чем при сканди-навском методе, и, поскольку общий объем вводимой жидкости ограничен, то глюкоза вводится в виде высококонцентрированных растворов в центральные вены. Метод гипералиментации менее физиоло-гичен, чем метод сбалансированного ПП - он не обеспечивает достаточного поступления энергетиче-ского субстрата в периоде постепенной адаптации организма к углеводной нагрузке. Толерантность же к глюкозе у тяжело больных новорожденных, особенно недоношенных, снижена из-за выброса кон-тринсулярных гормонов. Поэтому в начальном периоде проведения ПП по методу гипералиментации гипергликемия и глюкозурия являются частыми, хотя и легкоустранимыми осложнениями. Длитель-ное же поступление больших доз углеводов - 20-30 г сухого вещества на 1 кг массы тела вызывает значительный выброс эндогенного инсулина, что обуславливает частоту гипогликемии и вызывает за-труднения при отмене ПП по этой системе. Кроме того, применение жировых эмульсий обеспечивает организм полиненасыщенными жирными кислотами, способствует защите стенки вен от раздражения гиперсмолярными растворами. Таким образом, применение сбалансированного ПП следует считать предпочтительным, однако при отсутствии жировых эмульсий вполне возможно обеспечить ребенка необходимой энергией только за счет глюкозы. По классическим схемам ПП за счет глюкозы дети по-лучают 60-70% небелкового энергообеспечения, за счет жира 30-40%. При введении жиров в меньших пропорциях задержка белка в организме новорожденных уменьшается (4).
- Расчет общего объема жидкости, необходимой ребенку на сутки.
- Решение вопроса о применении препаратов для инфузионной терапии специального назначения (кровь, плазма, реополиглюкин, иммуноглобулин) и их объеме.
- Расчет количества концентрированных растворов электролитов, необходимых ребенку, исходя из фи-зиологической суточной потребности и величины выявленного дефицита. При расчете потребности в натрии необходимо учесть его содержание в кровезаменителях и растворах, применяемых для струйных внутривенных инъекций.
- Определение объема раствора аминокислот, исходя из следующего приблизительного расчета:
- Определение объема жировой эмульсии. В начале применения ее доза составляет 0,5 г/кг, затем повышается до 2,0 г/кг.
- Определение объема раствора глюкозы. Для этого из объема, полученного в п.1 вычесть объемы, полученные в пп. 2-5. В первые сутки ПП назначают 10% раствор глюкозы, на вторые - 15%, с третьих суток - 20% раствор (под контролем глюкозы крови).
- Проверка и, при необходимости, коррекция соотношений между пластическими и энергетическими субстратами. При недостаточном энергообеспечении в пересчете на 1 г аминокислот следует увеличить дозу глюкозы и/или жира, либо уменьшить дозу аминокислот.
- Распределить полученные объемы препаратов для инфузии исходя из того, что жировая эмульсия не смешивается с другими препаратами и вводится либо по-стоянно на протяжении суток через тройник, либо в составе общей инфузионной программы в два-три приема со скоростью, не превышающей 5-7 мл/час. Растворы аминокислот смешивают с глюкозой и растворами электролитов. Скорость их введе-ния рассчитывают таким образом, чтобы общее время инфузии составляло 24 часа в сутки.
- Дополнительное введение натрия не показано (с плазмой и физиологиче-ским раствором, на котором разводят вводимые струйно препараты, получает 2,3 ммоль/кг натрия). Потребность в калии составляет 3 ммоль/кг = 9 ммоль = 9 мл 7,5% раствора хлорида калия. Потребность в магнии обеспечивается сульфатом магния 25% р-р 0,1 мл/кг = 0,3 мл. Потребность в кальции -1 мл/кг = 3 мл. Объем жид-кости для введения электролитов составляет 20 мл (с учетом введения других меди-каментов).
- Доза аминокислот составляет 2 г/кг = 6 г. При применении препарата Ами-новеноз (Fгеsеnius), который содержит 6% аминокислот (6 г в 100 мл) его объем со-ставит 100 мл.
- Доза жировой эмульсии 2 г/кг = 6 г. При применении препарата Липовеноз 20% (Fгеsеnius) (20 г в 100 мл) его объем составит 30 мл.
- Объем глюкозы составит:
360 мл - 30 мл - 20 мл -100 мл - 30 мл = 180 мл
Поскольку ребенок получал ПП с постепенным возрастанием концентрации глюкозы уже в течение 5 дней и гипергликемии не отмечалось, назначается 20 % глюкоза. - Проверка: Доза аминокислот 6 г. Энергообеспечение за счет жира 6 г = 60 ккал. Энергообеспечение за счет глюкозы 180 мл 20% раствора = 36 г = 144 ккал. Всего на 1 г аминокислот приходится 34 ккал. Общее энергообеспечение 24 ккал (РКА) +60 ккал (жир) + 144 ккал (глюкоза) = 228 ккал = 76 ккал/кг.
- Назначения:
Липовеноз 20% 30 мл через тройник со скоростью 1,3 мл/час
Аминовеноз пед 6% - 40,0
Глюкоза 20% - 60,0
Калия хлорид 7,5%- 4,5
#
Аминовеноз пед 6% - 30,0 Глюкоза 20% - 60,0
Глюконат кальция 10% - 3,0
#
Скорость 13 мл/час
Плазма В (111) -30,0
#
Аминовеноз пед 6% - 30,0
Глюкоза 20% - 60,0
Калия хлорид 7,5% - 4,5
Магния сульфат 25% - 0,3
Рост новорожденных и недоношенных детей не прекращается и не замедляется после рождения. Соответственно постнатальная потребность в калориях и белках не уменьшается! До тех пор, пока недоношенный новорожденный не способен к полному энтеральному усвоению, важным является парентеральное покрытие этих потребностей.
Особенно это касается дотаций глюкозы сразу после рождения, в противном случае это грозит выраженной гипогликемией. С постепенным становлением энтерального питания парентеральная инфузионная терапия может быть редуцирована.
Использование компьютерных программ (например, Visite 2000) для подсчета и приготовления инфузионных растворов и медикаментов уменьшает риск ошибок и улучшает качество [Е2].
Объем инфузии
1-е сутки (день рождения):
Поступление жидкости:
- Общий объем инфузии может варьировать в зависимости от баланса, артериального давления, способности к энтеральному усвоению, уровня сахара в крови и дополнительных сосудистых доступов (например, артериальный катетер + 4,8-7,3 мл/день).
Витамин К
- недоношенные с массой тела > 1500 г: 2 мг внутрь (если ребенок находится в удовлетворительном состоянии), в противном случае 100-200 мкг/кг массы тела внутримышечно, подкожно или внутривенно медленно.
- недоношенные с массой тела < 1500 г: 100-200 мкг/кг массы тела внутримышечно, подкожно или внутривенно медленно (максимальная абсолютная доза 1 мг).
- альтернатива: 3 мл/кг массы тела Vitalipid infant с первого дня жизни.
Внимание : дотации глюкозы составляют приблизительно 4,2 мг/кг/ мин - контролировать уровень сахара, при необходимости давать более высокие концентрации возможны при наличии центрального катетера!
2-е сутки жизни: поступление жидкости увеличивается на 15 мл/кг массы тела/сутки в зависимости от баланса, диуреза, удельного веса мочи, отеков и массы тела. Дополнительно:
- Натрий, калий, хлорид в зависимости от лабораторных данных.
- Внутривенное введение глюкозы: 8-10 (-12 у доношенных новорожденных) мг/кг/мин глюкозы. увеличивать или снижать дозу в зависимости от уровня сахара в крови и глюкозурии, цель: нормогликемия.
- Жировая эмульсия 20 % 2,5-5 мл/кг за 24 часа при массе тела < 1500 г.
- Витамины: 3 мл/кг Vitalipid infant и 1 мл/кг Soluvit-N.
- Глицеро-1-фосфат 1,2 мл/кг/сутки.
3-е сутки жизни: поступление жидкости увеличивается на 15 мл/кг массы тела/сутки в зависимости от баланса, диуреза, удельного веса мочи, отеков и массы тела. Дополнительно:
- Жировая эмульсия 20% - увеличить дозу до 5-10 мл/кг/сутки.
- Магний, цинк и микроэлементы (у недоношенных со сроком гестации < 28 недель возможно назначение уже с 1-2 дня жизни).
После третьих суток жизни:
- Введение жидкости повышать приблизителен: до 130 (-150) мл/кг/ сутки в зависимости от массы тела, баланс;., диуреза, удельного веса мочи, отеков, неощутимых потерь жидкости и достижимого калоража (большая вариабельность).
- Калории: по возможности наращивать каждый день. Цель: 100-130 ккал/кг/сутки.
- Наращивание энтерального кормления: объем энтерального питания увеличивается в зависимости от клинического состояния, остаточного объема в желудке и результатов наблюдения медицинского персонала: на 1-3 мл/кг за одно кормление (при зондовом кормлении максимальный объем увеличения энтерального питания составляет 24-30 мл/сутки).
- Белки: при полном парентеральном питании цель составляет как минимум 3 г/кг/день.
- Жиры: максимально 3-4 г/кг/сутки внутривенно, что приблизительно составляет 40-50 % парентерально обеспечиваемых калорий.
Обратите внимание на применение /способ введения:
При периферическом венозном доступе максимально допустимая концентрация глюкозы в инфузионном растворе составляет 12 %.
При центральном венозном доступе концентрация глюкозы в случае необходимости может быть повышена до 66 %. Однако доля раствора глюкозы в общей инфузии должна составлять < 25-30 %.
Витамины должны быть защищены от света (желтая инфузионная система).
Никогда не вводить вместе кальций и бикарбонат натрия! Возможна дополнительная инфузия кальция, которая может быть прервана на время введения бикарбоната натрия.
Кальций, внутривенные жировые эмульсии и гепарин вместе (совмещенные в одном растворе) выпадают в осадок!
Гепарин (1 МЕ/мл): разрешено введение через пупочный артериальный катетер или периферический артериальный катетер, не вводить через силастиковый катетер.
При проведении фототерапии жировые эмульсии для внутривенного введения должны быть защищены от света (желтая «инфузионная система с фильтром, светозащищенная»).
Растворы и вещества
Осторожно все инфузионные растворы в стеклянных флаконах содержат алюминий, который во время хранения высвобождается из стекла! Алюминий нейротоксичен и у нетоношенных детей может приводить к нарушениям неврологического развития. Поэтому по возможности использовать препараты в пластиковых флаконах или в больших стеклянных упаковках.
Углеводы (глюкоза):
- При полном парентеральном питании недоношенным детям необходимо до 12 мг/кг/мин глюкозы, как минимум 8-10 мг/кг/мин, что соответствует 46-57 ккал/кг/сутки.
- Чрезмерные дотации глюкозы приводят к гипергликемии [Е], повышенному липогенезу и возникновению жировой дистрофии печени [Е2-3]. Увеличивается продукция С02 и, вследствие этого, минутный объем дыхания [ЕЗ], ухудшается метаболизм белков [Е2-3].
- Высокий уровень сахара в крови у недоношенных детей повышает риск заболеваемости и смертности, а также смертности от инфекционных причин [Е2-3, взрослые].
- Следует избегать введения глюкозы >18 г/кг.
Совет : при гипергликемии следует уменьшить дотации глюкозы, возможно назначение инсулина. Инсулин адсорбируется на стенках инфузионной системы, поэтому необходимо использовать инфузионные системы из полиэтилена или предварительно промыть инфузионную систему 50 мл раствора инсулина. Экстремально незрелые младенцы и недоношенные дети с инфекционными проблемами особенно склонны к гипергликемии! При персистируюшей гипергликемии требуется раннее назначение инсулина во избежание длительного гипокалорийного питания ребенка.
Белок:
- Использовать только тауринсодержащие растворы аминокислот (Aminopad или Primene). У недоношенных детей начинать с первого дня жизни. Для достижения положительного азотистого баланса необходимо минимум 1,5 г/кг/сутки [Е1]. У недоношенных детей максимальное количество составляет 4 г/кг/сутки, у доношенных - 3 г/ кг/сутки [Е2].
- Растворы аминокислот должны храниться в защищенном от света месте, во время проведения инфузии защита от света необязательна.
Жиры:
- Использовать жировые эмульсии для внутривенного введения на основе смеси оливкового и соевого масла (например, Clinoleic; вероятно оказывает благоприятное влияние на метаболизм простагландинов), либо на основе чистого соевого масла (например, Intralipid, LipovenOs 20 %).
- Для предотвращения дефицита незаменимых жирных кислот необходимо назначать как минимум 0,5-1,0 г жиров/кг/сутки в зависимости от состава эмульсии (потребность по линолевой кислоте составляет как минимум 0,25 г/кг/сутки для недоношенных и 0,1 г/ кг/сутки для доношенных детей) [Е4]. Инфузия в течение 24 часов [Е2].
- Уровень триглицеридов должен оставаться < 250 мг/дл [Е4|.
- Жировые эмульсии могут назначаться также при гемолитических анемиях и инфекциях, за исключением тех случаев, когда уровень билирубина достигает границы заменного переливания крови, или в случае септического шока. Недостаточное питание ослабляет иммунную систему!
Опасайтесь ацидоза.
Внимание : при наличии инфекции, а также у новорожденных с экстремально низкой массой тела уровень триглицеридов в крови необходимо контролировать при введении липидов уже в дозе 1-2 г/кг/сутки!
Микроэлементы: при длительном парентеральном питании (> 2 недель) или у недоношенных детей со сроком гестации < 28 недель начинать с 1-3 дня жизни:
- Уницинк (Zink-DL-Hydrogenaspartat): 1 мл соответствует 650 мкг.
- Потребность: 150 мкг/кг/сутки в первые 14 дней, затем 400 мкг/кг/ сутки.
- Peditrace: назначать при полном парентеральном питании > 2 недель.
- Селен (Selenase): при очень длительном парентеральном питании (месяцы!). Потребность: 5 мкг/кг/сутки.
Внимание в Peditrace содержится 2 мкг/мл селена.
Внимание в Peditrace содержится 250 мкг/мл цинка - необходимо уменьшить дотации уницинка до 0,2 мл/кг/сутки.
Витамины:
Жирорастворимые витамины (Vitalipid infant): в случае непереносимости внутривенного введения липидов можно вводить Vital lipid, разведенный в аминокислотах или физиологическом растворе, или медленно - неразведенный препарат (за 18-24 часа), максимально 10 мл/сутки.
Водорастворимые витамины (Soluvit-N): в Германии разрешен к использованию у детей с 11 лет. В других странах Европы разрешено применять также у новорожденных и недоношенных детей.
Потребность: потребности практически для всех витаминов точно не известны. Все витамины должны вводиться ежедневно, за исключением витамина К, который может назначаться 1 раз в неделю. Нет необходимости в рутинном определении уровня витаминов в крови.
Особые замечания:
- Ни один из перечисленных препаратов для парентеральной дотации витаминов не разрешен к использованию у недоношенных детей. Vitalipid Infant разрешен к использованию у доношенных новорожденных, все другие препараты - у детей старше 2 или даже 11 лет.
- Указанная доза Vitalipid Infant (1 мл/кг) является слишком низкой.
- Жирорастворимый Frekavit имеет лучшее соотношение витамина А к витамину Е.
Блокировка периферического венозного доступа гепарином, который используется периодически (непостоянно), является спорной.
Лабораторные исследования для контроля питания
Замечание : каждый забор крови для лабораторного обследования должен быть строго обоснованным. У недоношенных детей с массой тела > 1200 г и находящихся в стабильном состоянии для контроля питания достаточно 1 раз в 2-3 недели проводить рутинные лабораторные исследования.
Кровь:
- Уровень сахара: Вначале контролировать уровень сахара как минимум 4 раза в день, затем - ежедневно натощак. Если нет глюкозурии, то коррекция не требуется при уровне сахара до 150 мг/дл, что соответствует 10 ммоль/л.
- Электролиты при преимущественном парентеральном питании: Натрий, калий, фосфор и кальций у недоношенных детей с массой тела < 1000 г вначале контролировать от одного до двух раз в день, затем при стабильных уровнях 1-2 раза в неделю. Хлор при преобладании метаболического алкалоза (BE полож.).
- Триглицериды: при внутривенном введении жиров 1 раз в неделю (цель < 250 мг/дл или 2,9 "Ммоль/л), при тяжелом состоянии ребенка и у глубоко недоношенных детей - чаще.
- Мочевина (< 20 мг/дл или 3„3 ммоль/л признак недостатка белка) 1 раз в неделю.
- Креатинин 1 раз в неделю.
- Ферритин с 4-й недели жизни (назначение железа, норма 30- 200 мкг/л).
- Ретикулоциты с 4-й недели жизни.
Кровь и моча: кальций, фосфор, креатинин в сыворотке и моче 1 раз в неделю, начиная с 3 недели жизни. Желаемые уровни:
- Кальций в моче: 1,2-3 ммоль/л (0,05 г/л)
- Фосфор в моче: 1-2 ммоль/л (0,031-0,063 г/л).
- Контролировать, если уровень кальция и фосфора в моче не определяется.
- При 2-кратном отрицательном результате определения кальция и фосфора в моче: повысить дотации.
Контроль диуреза
Все время, пока проводится инфузионная терапия.
У недоношенных детей с массой тела < 1500 г подсчет баланса введенной и выделенной жидкости проводится 2 раза в сутки.
Цель: диурез приблизительно 3-4 мл/кг/час.
Диурез зависит от объема вводимой жидкости, зрелости ребенка, тубулярной функции почек, глюкозурии и т.д
Осложнения парентерального питания
Инфекции:
- К доказанным рискам нозокомиальных инфекций (мультивариантный анализ) относятся: длительность парентерального питания, длительность стояния центрального венозного катетера и манипуляции с катетером. Поэтому следует избегать ненужных рассоединений инфузионной системы [Е1Ь]. Рассоединение инфузионной системы проводить после дезинфекции и только в стерильных перчатках. Кровь и остатки питательного инфузионного раствора с канюли катетера удалять стерильной, пропитанной дезсредством салфеткой, салфетку удалить. Перед и после каждого рассоединения инфузионной системы проводить дезинфекцию канюли катетера [все Elbj.
- Системы с парентеральными жировыми растворами должны меняться каждые 24 часа, остальные не реже 72 часов (вывод из «взрослой» медицины, который позволяет уменьшить рассоединения инфузионной системы).
- Не рекомендуется постановка катетеров с микрофильтрами (0,2 мкм) с целью предотвращения катетер-ассоциированных инфекций [ЕЗ].
- Следует полностью соблюдать рекомендации института Коха по предотвращению нозокомиальных инфекций у пациентов отделений интенсивной терапии с массой тела при рождении < 1500 г.
Закупорка центрального венозного катетера.
Перикардиальный выпот: экстравазат в перикарде является жизнеугрожающим состоянием. Поэтому конец центрального венозного катетера должен находиться за пределами контура сердца (у недоношенных детей на 0,5 см выше при стоянии в яремной или подключичной вене) [Е4].
Холестаз: патогенез ППП-ассоциированного холестаза до конца не ясен. Вероятнее всего, речь идет о мультифакториальном событии, в развитии которого совместную роль играют инфекция, состав растворов для парентерального питания и основное заболевание. Несомненно, что протективные функции выполняют как можно более раннее начало энтерального питания, особенно материнским молоком, и состав питания. В то же время недостаток или переизбыток питания, недостаток или переизбыток аминокислот, а также избыточное поступление глюкозы являются вредными. Недоношенность, особенно в комбинации с некротическим энтероколитом или септическими инфекциями, является фактором риска [Е4]. Если уровень конъюгированного билирубина без видимых причин непрерывно нарастает, инфузия липидов должна быть уменьшена или остановлена. При непрерывном нарастании уровней трансаминаз. щелочной фосфатазы или конъюгированного билирубина должна быть назначена терапия урсодезоксихолевой кислотой. При ППП > 3 месяцев и уровне билирубина > 50 мкмоль/л, тромбоцитопении < 10/нл, повреждениях мозга или печеночном фиброзе необходимо раннее направление в педиатрический центр по трансплантации печени [Е4].
При парентеральном питании питательные вещества вводятся в организм новорожденного внутривенно (устанавливается катетер для питания). Таким образом ребенок получает необходимые для жизни и развития углеводы, жиры, аминокислоты, а также витамины и микроэлементы напрямую, минуя желудочно-кишечный тракт.
Этот вариант применяют, если младенец не может принимать пищу обычным способом. Оно может быть полным и частичным (когда полезные вещества отчасти получаются через ЖКТ). Сегодня мы постараемся рассказать о том, при каких показаниях проводят парентеральное питание новорожденных.

Показания
Парентеральное питание (ПП) – это важнейшая часть выхаживания и лечения младенцев с очень маленькой массой тела или хирургическими дефектами. Новорожденный должен получать полноценное кормление без перерывов. Голодание в период после появления на свет может привести, кроме прочего, к неправильному развитию нервной системы.
ПП уже давно применяется в следующих случаях :
- когда потребление пищи через ЖКТ невозможно;
- питание проходит с нарушениями из-за патологии;
- при недоношенности ребенка.

Активное развитие медицинских технологий позволило выхаживать даже новорожденных с чрезвычайно низкой массой тела. Вскармливание таких младенцев – главнейшая часть борьбы за их жизнь.
Справка! Частичный или полный вариант парентерального метода вскармливания назначается специалистами неонатологами, если при энтеральном питании (при котором пища проходит через ЖКТ) потребность в питательных веществах не превышает 90 процентов их потребности .
Противопоказания
Нельзя проводить ПП при проведении реанимационных действий. Его назначают только после того, как состояние ребенка станет стабильным. Никаких других противопоказаний для ПП нет.

Протокол парентерального питания новорожденных
Для спасения больного новорожденного ребенка необходимо проведение подходящего ПП, которое поможет избежать осложнений и позволит нормально расти и развиваться. Введение в практику современных протоколов ПП для недоношенных детей способствует наилучшему потреблению необходимых веществ и сокращению нахождения в отделении интенсивной терапии.
Внимание! В норме плод получает питательные вещества через плаценту. В последние две недели вынашивания он интенсивно растет. Чем раньше случились преждевременные роды, тем меньше у ребенка запас питательных веществ.
Сразу после пересечения пуповины поступление нужных веществ привычным путем останавливается. При этом необходимость в них не уходит. Но органы пищеварения недоношенного младенца ни структурно, не функционально еще не готовы к полноценному потреблению.

Наилучшей моделью для развития недоношенного ребенка для врачей становится внутриутробный вариант. Поэтому подбирается такой сбалансированный состав ПП, который максимально соответствует внутриутробному питанию .
При назначении каждого ингредиента ПП учитываются индивидуальные потребности младенца. Сочетание компонентов должно формировать правильный обмен веществ в организме и бороться с возможными заболеваниями. Специфика проведения ПП способствует его лучшему усвоению.
Особенности! Эффективность парентерального питания можно оценить только по гармоничному росту и развитию малыша.
Начиная проведение ПП, определяют такие показатели, как :
- содержание глюкозы в крови;
- уровень триглицеридов в плазме крови;
- электролиты (кальций, калий и натрий);
- уровень билирубина;
- содержание трансаминаз.
Каждый день снимаются такие показатели :
- изменение массы тела;
- диурез;
- содержание глюкозы в моче и в крови;
- содержание электролитов в крови;
- уровень триглицеридов.
Как рассчитать: пример расчета парентерального питания у новорожденных
Программа ПП подбирается индивидуально для каждого новорожденного. Рассчитывается необходимое количество жидкости. Принимается решение о препаратах, которые будут вводиться. Делаются выводы об объемах, составляющих ПП, его распределение. Далее - проверка ПП и его коррекция (если необходимо).
Расчет парентерального питания у новорожденных проводится с помощью специальных компьютерных программ (например программы «калькулятор расчета» ). Ниже приведены позиции, которые необходимо рассчитать.
- Общее количество жидкости.
- Объем энтерального питания.
- Объем электролитов.
- Количество глюкозы, которое определяется с учетом скорости утилизации.
- Количество жировой эмульсии.
- Требуемая доза аминокислот.
- Объем, который приходится на глюкозу.
- Подбор различных концентраций глюкозы.
- Скорость введения.
- Необходимое количество калорий ежесуточно.
Метод ПП может применяться только как временный подход к вскармливанию новорожденного. Парентеральное питание не физиологично, поэтому со временем надо стараться переходить к нормальному кормлению ребенка. Если младенец может потреблять хотя бы чуть-чуть материнского молока, врач назначит энтеральное питание для налаживания работы ЖКТ ребенка.

Парентеральное питание новорожденных: методические рекомендации
Тема выхаживания недоношенных детей очень непроста. Тем, кто хотел бы больше узнать о парентеральном питании, будет полезно посмотреть видео , представленное ниже.