L50.0 Аллергическая крапивница. Злокачественные новообразования молочной железы. Рак молочной железы Заболевание д 50
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив - Клинические протоколы МЗ РК - 2007 (Приказ №764)
Молочной железы неуточненной части (C50.9)
Общая информация
Краткое описание
Самая частая опухоль у женщин, относящаяся к классическим гормонообусловленным онкологическим заболеваниям; развивается в органе, являющемся частью репродуктивной системы организма. Эти опухоли происходят из эпителиальной ткани протоков или долек молочной железы - "мишени" для гормонов, вырабатываемых яичниками (эстрогены и прогестины).
В среднем в Республике Казахстан ежегодно выявляется около 3000 больных раком молочной железы, из которых умирают более 1380 женщин. В частности, в 2005 году зарегистрировано 2954 случаев рака молочной железы, что составило 19,5 (32, 3 в г. Алматы) на 100 000 населения. Летальность на 1 году жизни составляет 10,8 %, а 5-летняя выживаемость 49,3 %.
Код протокола:
H-S-008 "Злокачественные новообразования молочной железы. Рак молочной железы"
Профиль : хирургический
Этап:
стационар
Код (коды) по МКБ-10:
C50 Злокачественное новообразование молочной железы
Классификация
Гистологическая классификация опухолей молочной железы
В настоящее время принято использовать гистологическую классификацию Международного противоракового союза (2002 г., 6-е издание).
| А | Неинвазивный рак (in situ): |
| Внутрипротоковый (интраканаликулярный) рак in situ | |
| Дольковый (лобулярный) рак in situ | |
| В | Инвазивный рак (инфильтрирующая карцинома): |
| Протоковый | |
| Дольковый | |
| Слизистый (муцинозный) | |
| Медуллярный (мозговидный) | |
| Тубулярный | |
| Апокриновый | |
|
Другие формы (папиллярный, плоскоклеточный, ювенильный, веретеноклеточный, псевдосаркоматозный и др.) |
|
| С | Особые (анатомо-клинические) формы: |
| Рак Педжета | |
| Воспалительный рак |
Чаще всего у больных встречается инвазивный протоковый рак (50-70%), затем дольковый (20%). Протоковый рак характеризуется более частым распространением по молочным ходам, а дольковый - первичной множественностью и двусторонностью.
МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ TNM
В настоящее время используется классификация опухолей по системе TNM международного противоракового союза (2002 г.). Стадия рака устанавливается при первичном обследовании больного, а затем уточняется после операции (pTNM).
Классификация относится только к карциномам и касается как мужской груди, так и женской молочной железы.
В случае наличия первично-множественных синхронных опухолей в одной молочной железе, для классификации должна быть взята опухоль с самой высокой
категорией Т. Синхронные двусторонние опухоли молочной железы должны классифицироваться независимо друг от друга чтобы дать возможность разделения случаев по гистологическому типу.
Для оценки категорий Т, N и M должны использоваться следующие методы:
Анатомические области:
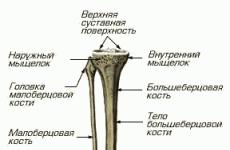
1. Сосок (С 50.0).
2. Центральная часть (С 50.1).
3. Верхневнутренний квадрант (С 50.2).
4. Нижневнутренний квадрант (С 50.3).
5. Верхненаружный квадрант (С 50.4).
6. Нижненаружный квадрант (С 50.5).
7. Подмышечный хвост (С 50.6).
Регионарные лимфоузлы:
1. Подмышечные (ипсилатеральные), межгрудные узлы (Роттера) и лимфоузлы вдоль подмышечной вены и ее ветвей которые могут быть разделены на следующие уровни:
Уровень I (нижняя часть подмышечной ямки): лимфоузлы, расположенные латерально по отношению к латеральной границе малой грудной мышцы;
Уровень II (средняя часть подмышечной ямки): лимфоузлы, расположенные между медиальной и латеральной границей малой грудной мышцы, и межгрудные лимфоузлы (Роттера);
Уровень III (верхушечная часть подмышечной ямки): апикальные лимфоузлы и узлы расположенные медиально по отношению к медиальному краю малой грудной мышцы, за исключением тех, которые определяются как подключичные.
Примечание. Внутримаммарные лимфоузлы кодируются как подмышечные лимфоузлы.
2. Подключичные (ипсилатеральные) лимфоузлы.
3. Внутримаммарные (ипсилатеральные) лимфоузлы: лимфоузлы в межреберных областях по краю грудины в эндоторакальной фасции.
4. Надключичные (ипсилатеральные) лимфоузлы.
Метастазы в любых других лимфоузлах определяются как отдаленные метастазы (М1), включая шейные или контралатеральные внутримаммарные лимфоузлы.
Под символами TNM подразумевают: T - первичная опухоль.
| Тх | Недостаточно данных для оценки первичной опухоли. |
| Т0 | Опухоль в молочной железе не определяется. |
| Тis |
Прединвазивная карцинома (carcinoma in situ) Тis (DCIS) - протоковая карцинома in situ Тis (LCIS) - дольковая карцинома in situ Тis (Paget) - болезнь Педжета (соска) без опухоли Примечание: болезнь Педжета с наличием опухоли классифицируется в соответствии с размером опухоли. |
| Т1 | Опухоль не более 2 см в наибольшем измерении |
| Т1mic |
Микроинвазия до 0,1 см в наибольшем измерении Примечание: микроинвазией считают распространение раковых клеток за пределы базальной мембраны с очагами менее 0,1 см Если очаги микроинвазии множественные, классифицируется наибольший по размеру очаг (нельзя суммировать размеры микроочагов) Наличие множественных очагов микроинвазии следует отмечать дополнительно |
| Т1а | Опухоль более 0,1 см, но не более 0,5 см в наибольшем измерении |
| Т1b | Опухоль более 0,5 см, но не более 1 см в наибольшем измерении |
| Т1с | Опухоль более 1 см, но не более 2 см в наибольшем измерении |
| T2 | Опухоль более 2 см, но не более 5 см в наибольшем измерении |
| Т3 | Опухоль более 5 см в наибольшем измерении |
| Т4 |
Опухоль любого размера с прямым распространением на грудную стенку или кожу Примечание: грудная стенка включает ребра, межреберные мышцы и переднюю зубчатую мышцу, но не грудную мышцу |
| Т4a | Распространение на грудную стенку |
| Т4b |
Отек (включая «лимонную корочку»), или изъязвление кожи молочной железы, или сателлиты в коже молочной железы |
| Т4c | Признаки перечисленные в 4а и 4b вместе |
| Т4d | Воспалительная форма рака молочной железы |
Примечание: воспалительная карцинома молочной железы характеризуется диффузной бурой индурацией кожи с эризипелоидным краем, обычно без подлежащей массы. Если биопсия кожи указывает на отсутствие вовлеченности в процесс и нет локализованного с определяемыми размерами первичного рака, категория Т есть рТх при патогистологическом стадировании воспалительной карциномы (Т4d).
Кожа, покрытая ямочками, втяжение соска или другие изменения кожи, за исключением тех, что бывают при Т4b и Т4d , могут оцениваться как Т1, Т2, или Т3, не влияя при этом на классификацию.
N - регионарные лимфатические узлы.
| NX | Недостаточно данных для оценки состояния регионарных лимфатических узлов |
| N0 | Нет признаков метастатического поражения регионарных лимфатических узлов |
| N1 |
Метастазы в смещаемых подмышечных лимфатических узлах (е) на стороне поражения |
|
N2
N2а N2b |
Метастаз в неподвижном ипсилатеральном подмышечном лимфатическом узле (ах) или в клинически явном ипсилатеральном внутримаммарном лимфоузле (ах) При отсутствии клинически явных метастазов в подмышечных лимфоузлах метастаз в подмышечном лимфатическом узле (ах), сцепленных друг с другом или с другими структурами Метастаз только в клинически явном внутримаммарном лимфоузле (ах), при отсутствии клинически явного метастаза в подмышечном лимфоузле |
| N3 |
Метастаз в ипсилатеральном подключичном лимфатическом узле (ах) с поражением подмышечных лимфоузлов или без них; или в клинически явном ипсилатеральном внутримаммарном лимфоузле(ах) при наличии клинически явных метастазов в подмышечных лимфоузлах; или метастаз в ипсилатеральном надключичном лимфоузле(ах) с поражением подмышечных или внутримаммарных лимфоузлов или без них |
|
N3а N3b N3с |
Метастаз в подключичном лимфоузле (ах) Метастазы во внутримаммарных и подмышечных лимфоузлах |
|
Примечание. «Клинически явные» означает выявленные в результате клинического исследования или применения средств визуализации (за исключением лимфосцинтиграфии) |
М - отдаленные метастазы.
рTNM патогистологическая классификация.
рТ - первичная опухоль.
Для патогистологической классификации требуется исследование первичной карциномы, при отсутствии макроскопической опухоли по краям резекции. Случай можно классифицировать как рТ, если по краю имеется только микроскопическая опухоль.
Примечание. При классификации рТ размер опухоли есть величина инвазивного компонента. Если имеется большой компонент in situ (например 4 см) и малый инвазивный компонент (например, 0,5 см), опухоль классифицируется как рТ1а.
рN - регионарные лимфатические узлы.
Для гистопатологической классификации может быть предпринято исследование одного или более сторожевых лимфоузлов. Если классификация основывается только на биопсии сторожевого лимфоузла без последующей диссекции подмышечных лимфоузлов, то ее следует обозначать (sn) (sentinel node - сторожевой узел), например: pN1 (sn).
| рN1mi | Микрометастаз (более 0,2 мм, но не больше 2 мм в наибольшем измерении) |
| РN1 |
Метастазы в 1-3 ипсилатеральных подмышечных лимфоузлах (е) и/или в ипсилатеральных внутримаммарных узлах с микроскопическими метастазами выявленными в результате диссекции сторожевого лимфоузла, но клинически не явными |
| рN1а |
Метастазы в 1-3 подмышечных лимфоузлах (е), среди них по крайней мере один более 2 мм в наибольшем измерении |
|
рN1b рN1с |
Внутримаммарные лимфоузлы с микроскопическими метастазами, выявленными в результате диссекции сторожевого лимфоузла, но клинически не явными Метастазы в 1-3 подмышечных лимфоузлах и внутримаммарных лимфоузлах с микроскопическими метастазами, выявленными в результате диссекции сторожевого лимфоузла, но клинически не явными |
| рN2 |
Метастазы в 4-9 ипсилатеральных подмышечных лимфоузлах или в клинически явных ипсилатеральных внутримаммарных лимфоузлах, при |
|
Примечание. «Клинически не явные» означает не выявленные в результате клинического исследования или применения средств визуализации (за исключением лимфосцинтиграфии); «клинически явные» означает выявленные в результате клинического исследования или применения средств визуализации (за исключением лимфосцинтиграфии), или макроскопически визуальные. |
|
| рN2а |
Метастазы в 4-9 подмышечных лимфоузлах, среди них по крайней мере один размером более 2 мм |
| рN2b |
Метастаз в клинически явном внутримаммарном лимфоузле (ах) при отсутствии метастазов в подмышечных лимфоузлах |
| рN3 |
Метастазы в 10 или более ипсилатеральных подмышечных лимфоузлах; или в ипсилатеральных подключичных лимфоузлах; или в клинически явных ипсилатеральных внутримаммарных лимфоузлах, при наличии одного или более пораженных подмышечных лимфоузлов; или в более чем 3 подмышечных лимфоузлах с клинически не явными микроскопическими метастазами во внутримаммарных лимфоузлах; или в ипсилатеральных надключичных лимфоузлах |
| рN3а |
Метастазы в 10 или более подмышечных лимфоузлах (по крайней мере, один из них больше 2 мм) или метастазы в подключичных лимфоузлах |
| рN3b |
Метастаз в клинически явном внутримаммарном лимфоузле (ах) при наличии пораженного подмышечного лимфоузла (ов); или метастазы в более чем 3 подмышечных лимфоузлах и во внутримаммарных лимфоузлах с микроскопическим метастазом, выявленным при диссекции сторожевого лимфоузла, но клинически не явным |
| рN3с | Метастаз в надключичном лимфоузле (ах) |
рМ - отдаленные метастазы. Категории рМ соответствуют категориям М.
G гистопатологическая классификация
G1 - высокая степень дифференцировки.
G2 - средняя степень дифференцировки.
G3 - низкая степень дифференцировки.
R классификация
Отсутствие или наличие остаточной опухоли после лечения описывается символом R. Определения R классификации:
RX - наличие остаточной опухоли не может быть установлено.
R0 - остаточная опухоль отсутствует.
R1 - микроскопическая остаточная опухоль.
R2 - макроскопическая остаточная опухоль.
Группировка по стадиям
| Стадия 0 | TiS | N0 | M0 |
| Стадия I | T1* | N0 | M0 |
| Стадия IIА | T0 | N1 | M0 |
| T1* | N1 | M0 | |
| T2 | N0 | M0 | |
| Стадия IIB | T2 | N1 | M0 |
| T3 | N0 | M0 | |
| Стадия IIIА | T0 | N2 | M0 |
| T1* | N2 | M0 | |
| T2 | N2 | M0 | |
| T3 | N1, N2 | M0 | |
| Стадия IIIB | T4 | N0, N1, N2 | M0 |
| Стадия IIIC | любая Т | N3 | M0 |
| Стадия IV | любая T | любая N | M1 |
Примечание. *Т1 включает Т1mic (микроинвазия 0,1 см или менее в наибольшем измерении).
|
Tis T1mic T1a T1b T1c T4a T4b T4d |
in situ £ 2см £ 0,1 см > 0,1 до 0,5 см > 0,5 до 1 см > 1 до 2 см > 2 до 5 см > 5 см Грудная стенка/кожа Грудная стенка Отек кожи/изъязвление, сателлитные узелки на коже Признаки характерные для T4a и T4b Воспалительная карцинома |
| N1 |
Подвижные подмышечные |
pN1mi pN1a pN1b pN1c |
Микрометастазы, > 0,2 мм £ 2 мм 1-3 Подмышечных узла Внутримаммарные узлы с микрометастазом, выявленном при биопсии сторожевого узла, но клинически неопределяемом 1-3 Подмышечных узла и внутримаммарные узлы с микрометастазом, выявляемом при биопсии сторожевого узла, но клинически неопределяемом |
| N2a |
Неподвижные подмышечные |
pN2a | 4-9 Подмышечных узлов |
| N2b |
Внутримаммар- ные клинически определяемые |
pN2b |
определяемые без подмышечных узлов |
| N3a | Подключичные | рN3a |
³ 10 Подмышечных узлов или подключичный узел (узлы) |
| N3b |
Внутримаммар- ные и подмышеч- ные |
рN3b |
Внутримаммарные узлы, клинически определяемые с подмышечным узлом (узлами) или > 3 подмышечных узла и внутримаммарных узлов с микрометастазами, которые выявляются при биопсии сентинельного (сторожевого узла), но клинически неопределяемых |
| N3c | Надключичные | рN3c | Надключичные |
Факторы и группы риска
Классификация факторов риска
1. Факторы, характеризующие функционирование репродуктивной системы организма:
Менструальная функция;
Половая функция;
Детородная фуцкция;
Лактационная функция;
2. Гиперпластические и воспалительные заболевания яичников и матки.
Эндокринно-метаболические факторы
, обусловленные сопутствующими и предшествующими заболеваниями:
1. Ожирение.
2. Гипертоническая болезнь.
3. Сахарный диабет.
4. Заболевание печени.
5. Атеросклероз.
6. Заболевания щитовидной железы.
7. Дисгормональные гиперплазии молочных желез.
Генетические факторы
(носители BRCA-1или BRCA-2 генов):
1. РМЖ у кровных родственников (наследственные и «семейные» РМЖ).
2. Молочно-яичниковый синдром (РМЖ и рак яичников в семье).
Экзогенные факторы
:
1. Ионизирующая радиация.
2. Химические канцерогены, в том числе и курение.
3. Избыточное потребление животных жиров, высококалорийная диета.
4. Вирусы.
5. Прием гормонов.
Диагностика
Жалобы (нет патогномоничных симптомов, характерных для рака молочной железы).
Могут быть жалобы на наличие образования в молочных железах, гиперемию, отек, морщинистость, втяжения или выпячивания на ней, сужение ареолярного поля и т.д.
Анамнез: наличие онкологических заболеваний у близких родственников, начало месячных, возраст первой беременности и первых родов, прием ОК или ГЗТ, гинекологические заболевания.
Физикальное обследование
1. Осмотр молочных желез.
При осмотре определяют:
Симметричность расположения и форму молочных желез;
Уровень стояния сосков и их вид (втяжение, отклонение в сторону);
Состояние кожи (гиперемия, отек, морщинистость, втяжения или выпячивания на ней, сужение ареолярного поля и т.д.);
Патологические выделения из соска (количество, цвет, длительность);
Наличие отека руки на стороне поражения.
2. Пальпация молочных желез (в вертикальном и горизонтальном положениях).
3. Пальпация регионарных и шейно-надключичных лимфатических узлов (как правило, производят в вертикальном положении).
Лабораторные исследования
Лабораторные исследования, которые необходимо выполнять при первичном обращении больной до начала лечения: общий анализ крови, группа крови, Rh-фактор, общий анализ мочи, биохимический анализ крови (мочевина, билирубин, глюкоза), RW (реакция Вассермана), коагулограмма, ЭКГ (электрокардиография).
Инструментальные исследования
Рентгенологическая диагностика является одним из ведущих методов выявления рака молочной железы, особенно если опухоль небольших размеров и не пальпируется. Маммография показана всем больным раком молочной железы.
Методы обследования, которые необходимо выполнить больной до начала лечения:
1. Пункционная биопсия опухоли с цитологическим исследованием или трепан-биопсия с определением уровня экспрессии ЭР, ПР, Her-2/neu и других генетических факторов.
2. Ультразвуковое исследование органов брюшной полости.
3. Рентгенологическое исследование легких.
4. Остеосцинтиграфия (в учреждениях, оснащенных радиоизотопной лабораторией).
5. Ультразвуковое исследование молочных желез, регионарных лимфоузлов.
Маммография и УЗИ дополняют друг друга, т.к. при маммографии могут быть видны опухоли которые не определяются при УЗИ, и наоборот.
Морфологическая диагностика:
1. Цитологическая (пункционная) биопсия (тонкоигольная биопсия).
2. Трепан-биопсия или секторальная резекция молочной железы.
Показания для консультации специалистов.
Обязательно: консультация гинеколога.
При необходимости консультация эндокринолога, невропатолога, уролога, радиолога, химиотерапевта, других смежных специалистов по показаниям.
Перечень основных диагностических мероприятий:
1. Определение гемоглобина.
2. Подсчет лейкоцитов в камере Горяева.
3. Подсчет эритроцитов на КФК.
4. Определение СОЭ.
5. Гематокрит.
6. Подсчет лейкоцитарной формулы.
7. Общий анализ мочи.
8. Определение общего белка.
9. Цитологическое исследование и гистологическое исследование ткани.
10. Определение времени свертываемости капиллярной крови.
11. Подсчет тромбоцитов.
12. Исследование крови на ВИЧ.
13. Микрореакция.
14. HbsAg, Anti-HCV.
15. Определение белковых фракций.
16. Определение билирубина.
17. Коагулограмма 1 (протромбиновое время, фибриноген, тромбиновое время, ачтв, фибринолитическая активность плазмы, гематокрит.
18. Определение остаточного азота.
19. Определение глюкозы.
20. Определение АЛТ.
21. Определение АСТ.
22. Тимоловая проба.
23. Определение группы крови и Резус-фактора.
24. УЗИ органов брюшной полости.
25. Электрокардиография.
26. Рентгенография грудной клетки в двух проекциях.
27. УЗИ молочных желез.
28. Маммография.
29. Дуктография.
30. УЗИ органов малого таза.
31. Магнитно-резонансная томография (МРТ) молочной железы.
32. Компьютерная томография (КТ) молочной железы.
Перечень дополнительных диагностических мероприятий:
1. Консультация кардиолога.
Дифференциальный диагноз
| Жалобы |
Физикальные данные |
УЗИ, маммография |
Морфологически е признаки |
|
| РМЖ |
Наличие образования в молочной железе, гиперемия, отек, морщинистость, выпячивания на ней, |
При осмотре наличие При пальпации наличие опухоли в МЖ, увеличенных регионарных лимфоузлов |
Наличие образование в молочной железе, кальцинатов, увеличение регионарных лимфоузлов |
Наличие клеток опухоли в мазках. Заключение патоморфолога о наличии злокачественной опухоли |
|
Воспалительные заболевания МЖ |
Гиперемия, гипертермия, боли в молочной железе, гнойные выделения |
При осмотре гиперемия При пальпации наличие болезненного уплотнения в МЖ, возможны реактивно увеличенные иногда лимфоузлы |
Наличие полости с жидкостным содержимым без четких границ |
Наличие элементов гнойного воспаления, лейкоцитов, нейтрофилов макрофагов, фибробластов в мазках. Гистологически - картина абсцесса, гнойная инфильтрация |
|
Фиброаденома, цистаденома МЖ, локализованный фиброаденома тоз |
Наличие образования в молочной железе, боли |
При осмотре возможна деформация МЖ. наличие уплотнения в МЖ |
Наличие образования с четкими контурами, при маммографии - наличие «ободка безопасности» |
Наличие пери-, интраканали- кулярной и смешанной фиброаденомы |
|
Киста молочной железы |
Наличие мягко-эластичного молочной железе, боли, выделения из соска |
При осмотре возможна деформация МЖ. При пальпации наличие образования мягко-эластической консистенции в МЖ |
Наличие полости с жидким содержимым с четкими контурами |
Наличие стенки кисты, жидкого содержимого |
Лечение за рубежом
Пройти лечение в Корее, Израиле, Германии, США
Получить консультацию по медтуризму
Лечение
Тактика лечения
Цели лечения:
достижение радикализма лечения.
Немедикаментозное лечение
РМЖ - одно из немногих онкологических заболеваний, при котором лечение всех стадий многовариантно.
Несмотря на значительный прогресс в разработке новых методов лечения РМЖ, хирургическое вмешательство по-прежнему остается основным, а в ряде случаев - единственным методом лечения этого заболевания (Са in situ).
Выбор того или иного вида радикальной операции определяется не только степенью распространения опухолевого процесса, но и клинической формой, локализацией опухоли, возрастом больных и некоторыми другими факторами характеризующими их общее состояние.
В последнее время все большее значение придается вопросам улучшения качества жизни, которое достигается выполнением органосохраняющих операций на молочной железе, а также реконструктивно-восстановительных операций с использованием местных тканей.
Органосохраняющие операции при РМЖ обеспечивают, наряду с высокими показателями выживаемости, хорошие косметические и функциональные результаты. Социально-трудовая реабилитация больных после сегментарной резекции молочной железы происходит быстрее, чем после мастэктомии.
Показания к выполнению органосохраняющих операций на молочной железе:
Наличие узловой формы рака размером до 2,5 см;
Отсутствие мультицентричности и мультифокальности опухолевого роста (на маммо-граммах, УЗИ, клинически);
Медленный и умеренный темпы роста, удвоение размера опухоли не быстрее чем за 3 месяца (по данным анамнеза);
Благоприятное соотношение размеров молочной железы и опухоли для получения хорошего косметического результата операции;
Отсутствие отдаленных метастазов;
Допустимо наличие одиночных метастазов в подмышечной области;
Реконструктивно-восстановительные операции могут выполняться при I-III стадиях РМЖ по желанию пациентки при любой локализации опухоли.
Женщина должна быть ознакомлена со всеми видами хирургических вмешательств.
Техника проведения лучевой терапии
Лучевая терапия молочной железы и зон регионарного метастазирования (надподключичной, подмышечной) осуществляется тормозным излучением ускорителя (6 МэВ) или на гамма-терапевтических аппаратах (1,25 МэВ), а парастернальной зоны - путем чередования фотонного и электронного пучков или только электронным излучением до 20 МэВ в зависимости от глубины залегания цепочки парастернальных лимфатических узлов.
Облучение парастернальной зоны с помощью 60С о или только фотонным пучком с энергией свыше 4 МэВ чревато развитием постлучевого пульмонита, медиастинита, перикардита. Предоперационную лучевую терапию во многих научных центрах мира не проводят, за исключением местно-распространенного РМЖ резистентных к неоадъювантной химиотерапии и эндокринотерапии.
Послеоперационное облучение передней грудной стенки после мастэктомии или облучения оставшейся молочной железы после радикальной резекции осуществляется фотонным пучком 1,25 МэВ или 6 МэВ с тангенциальных полей, направленных таким образом чтобы в зону 100%-й изодозы попадало не более 2 см легочной ткани.
Тангенциальные поля. Границы:
1. Верхняя - уровень грудинно-ключичного сочленения (угол Луиса); если необходимо, верхняя граница может быть расположена выше, чтобы включить всю молочную железу.
2. Медиальная - вдоль середины грудины.
3. Нижняя - на 2 см ниже субмаммарной (переходной) складки.
4. Латеральная - на 2 см латеральнее пальпируемой ткани молочной железы, обычно вдоль среднеподмышечной линии.
В послеоперационном периоде после мастэктомии границы тангенциальных полей следующие:
1. Верхняя - угол Луиса.
2. Медиальная - срединная линия тела.
3. Нижняя - на уровне субмаммарной складки противоположной железы.
4. Латеральная - средняя подмышечная линия.
При нетипичной локализации послеоперационого рубца и расположении его за пределами обозначенных границ полей облучения, рекомендуется дополнительное облучение зоны рубца с захватом тканей не менее чем на 2 см за его пределами. Такое облучение должно осуществляться электронным пучком или с помощью контактной лучевой терапии.
Надподключичное поле.
Облучение надподключичных и подмышечных лимфатических узлов происходит с переднего поля и наклоном пучка на 10-150 к одноименной стороне, чтобы избежать облучения пищевода и трахеи.
Верхний край поля - на уровне верхнего края перстнещитовидного углубления.
Медиальная граница - середина грудины.
Латеральная граница - медиальный край головки плеча; при необходимости облучения всей подмышечной впадины боковая граница должна быть расширена до латерального края головки плеча, которая должна быть прикрыта защитным блоком.
Нижняя граница соприкасается с верхней границей тангенциального поля на уровне прикрепления второго ребра к грудине (угол Луиса).
Всегда обязательно защищаются свинцовым блоком гортань, пищевод, трахея.
Заднее подмышечное поле используется при необходимости облучения всей подмышечной зоны.
Медиальная граница поля расположена на 1 см кнутри от края грудной клетки.
Верхняя граница - верхний край ключицы.
Боковая граница - латеральный край головки плеча.
Нижняя граница - тот же уровень, что и нижний край надподключичного поля.
Парастернальное поле. Границы:
Медиальный край - средняя линия грудины.
Латеральный край - на 4-5 см латеральнее средней линии.
Верхний край - нижний край надподключичного поля.
Нижний край - основание мечевидного отростка грудины.
При облучении нескольких смежных полей расстояние между границами этих полей следует определять в зависимости от выбранного вида энергии излучения.
Размеры поля облучения выбираются индивидуально при предлучевой подготовке с помощью УЗИ, компьютерного томографа, рентгеносимулятора.
Стандартное послеоперационное облучение проводится в режиме обычного фракционирования дозы (РОД 2 Гр, СОД 40 Гр) на молочную железу, грудную стенку и зоны регионарного метастазирования. При наличии в учреждении электронного пучка, у больных, подвергшихся сегментарной резекции, зона послеоперационного рубца (т.е. ложе опухоли) может дополнительно облучаться в дозе 12 Гр.
Адъювантная терапия рака молочной железы
Различные подтипы РМЖ стали ясно распознаваться на основании генетического профиля и иммуногистохимической демонстрации избранных мишеней (Sorlie,2001; Regan,2006). В общей лечебной стратегии подчеркивается первостепенная важность целенаправленной (таргетной) терапии, где это только возможно, хотя назначение дополнительной менее "таргетно-специфической" химиотерапии может потребоваться.
Стала очевидной абсолютная важность своевременной, точной и надежной гистопатоморфологической оценки, включая идентификацию мишеней. Поэтому тесный союз между клиницистами и патоморфологами обеспечит существенное улучшение отдаленных результатов лечения.
Дальнейшее разъяснение терминологии касалось и определения эндокринной чувствительности. Три категории чувствительности, описанные в 2005 году, в сущности остались без изменения, но были изложены определеннее в указаниях 2007 года:
1. Опухоли высоко чувствительные к эндокринотерапии (высокая экспрессия рецепторов эстрогенов (ЭР) и прогестерона (ПР) в большинстве опухолевых клеток).
2. Неполностью (недостаточно) чувствительные к эндокринотерапии опухоли (более низкая экспрессия ЭР и/или ПР).
3. Нечувствительные к эндокринотерапии опухоли (полное отсутствие как ЭР так и ПР).
Степень эндокринной чувствительности варьирует количественно и соотносится с оценкой риска рецидива для решения - достаточно ли будет назначения одной эндокринотерапии. Хотя невозможно определить абсолютный порог высокой эндокринной чувствительности, все же больных, входящих в группу низкого риска (табл.1), можно считать подходящими для одной эндокринотерапии, в то время как дополнительная химиотерапия может потребоваться больным также с высоко эндокринно чувствительными опухолями при наличии промежуточных или высоких факторов риска рецидива, а также больным с недостаточной эндокринной чувствительностью опухоли.
Перитуморальная инвазия сосудов должна быть экстенсивной (т.е. опухолевые эмболы наблюдаются в 2 и более блоках опухоли), чтобы отнести к повышенному риску;
Некоторые маленькие опухоли и гистологические подтипы могут быть отнесены к низкому риску, несмотря на отсутствие экспрессии рецепторов стероидных гормонов (например, медуллярная карцинома, апокриновая карцинома и т.д.);
Уровень экспрессии или амплификации HER2 являются и факторами риска, и, одновременно, терапевтическими мишенями.
Предложенный алгоритм (табл.2) должен помогать в выборе оптимальной терапии в ближайшем будущем.
Определены три категории чувствительности:
1.Высоко чувствительные к эндокринотерапии опухоли. Это опухоли с высокой экспрессией рецепторов обоих рецепторов стероидных гормонов (определяемых приемлемыми иммуно-гистохимическими методами).
2. Недостаточная чувствительность к эндокринотерапии (в классификации 2005 г. обозначавшаяся как неясная эндокринная чувствительность). При этих опухолях наблюдается некоторая экспрессия рецепторов стероидных гормонов, но на низких уровнях, или отсутствие экспрессии одного из рецепторов: ЭР или ПР.
3. Нечувствительные к эндокринотерапии опухоли. Отсутствует экспрессия рецепторов стероидных гормонов. Хотя эта группа ясно определена как нечувствительная к эндокринотерапии, она включает опухоли разного фенотипа (Sorlie, 2003).
HER2- позитивность
Существует две технологии определения НЕR2-позитивности.
Иммуногистохимическая методика - окрашивание (до 3+) более 30% опухолевых клеток.
Альтернативная методика - определение генной амплификации FISH методом (флюоресцентная in situ гибридизация: соотношение HER2-генных копий к центромерам хромосомы 17 более 2.2) или CISH методом (хромогенная in situ гибридизация) (Wolff, 2007).
Уже четко показано в ряде клинических испытаний, что наличие явного иммуногистохимичесиого окрашивания (HER2+++) ассоциируется с чувствительностью к трастузумабу. Теоретически более слабое окрашивание (1+ или 2+) даже при наличии амплификации должно ассоциироваться с меньшей степенью активности трастузумаба. В исследовании №9831 (Perez, 2007) оценивается эта гипотеза, однако необходимо большее число крупных испытаний корреляции между специфическими биологическими маркерами и анти-HER-терапией.
В 2007 г. Панель внесла небольшие изменения в классификацию риска (табл.1).
Перитуморальная сосудистая инвазия повышает категорию риска только в том случае, если она обширная (Colleoni, 2007). Полное отсутствие рецепторов стероидных гормонов и амплификация или повышенная экспрессия HER2 - каждый из этих признаков считается достаточным, чтобы исключить принадлежность к низкому риску, за исключением редких форм опухолей, таких как медуллярная или апокриновая карцинома, обычно не содержащие эти рецепторы.
Как и в 2005 Панель экспертов не приняла так называемый "молекулярный подход типа Qncotype Dx ™", "ген-экспрессионный профиль Мамма Print ™" в качестве достаточно точных тестов определения категории риска. Оба метода пока проверяются в проспективных клинических исследованиях (Sparano, 2006; Bogaerts, 2006).
СПЕЦИФИЧЕСКИЕ ПОДХОДЫ К ВЫБОРУ ЛЕЧЕНИЯ
Местное и регионарное лечение
Хирургические виды лечения, представленные на конференции в Сан-Галлене, в основном касались органосохраняющих операций, технологии обнаружения и удаления сигнальных лимфатических узлов с целью избежать избыточной подмышечной диссекции. Были также представлены обоснования хирургического вмешательства на молочной железе при наличии отдаленных метастазов. Однако эти аспекты хирургического лечения специально не рассматривались панелью экспертов.
Были обсуждены некоторые вопросы лучевой терапии. Решено, что указания ASCO и EUSOMA могут быть использованы в качестве практических рекомендаций планирования послеоперационной лучевой терапии (Recht, 2001; Kurtz, 2002).
Современные стандарты лучевой терапии предполагают использование СТ-сканирующего симулятора планировании лучевой терапии (особенно на лев. половину грудной клетки) и применение техники «минимального лучевого воздействия» на сердце (Korreman, 2006).
Наблюдалось полное согласие экспертов в отказе от лучевой терапии после мастэктомии у больных РМЖ без регионарных метастазов (рNО) с опухолями категории Т1-Т2. В то же время чуть более половины экспертов считают целесообразным проведение лучевого лечения при наличии 4-х и более пораженных лимфоузлов. Данные Оксфордской группы EBCTCG представленные в Сан-Антонио в декабре 2006 г., свидетельствуют о целесообразности лучевого лечения после мастэктомии и у женщин с 1-3 пораженными лимфоузлами.
У больных с вовлеченными лимфатическими узлами рекомендуется включать в объем облучения грудную стенку и надключичную обл. Эксперты согласились, что облучения подмышечной обл. следует избегать, если проведена полная подмышечная диссекция. Большинство экспертов предпочитают избегать лучевой
Терапии (даже после органосохраняющих операций) у пожилых пациентов, которым планируется эндокринотерапия. Лишь несколько членов Панели полагают, что и пожилые больные должны следовать стандартам лучевой терапии, если она показана.
Многие другие "новации" лучевой терапии не были поддержаны экспертами: одновременная (сочетанная) химио-лучевая терапия, "парциальная" лучевая терапия только ложа опухоли, укорочение продолжительности лучевой терапии с гипофранционированием. Не поддержано предложение отсрочки эндокринотерапии до окончания лучевой терапии.
ПРОГРАММА СИСТЕМНОЙ АДЪЮВАНТНОЙ ТЕРАПИИ
Как и в 2005 г. главным решением было определение приемлемой целенаправленной (таргетной) терапии. Для высоко чувствительных и недостаточно чувствительных к эндокринотерапии опухолей выбор гормонального лечения будет зависеть от менопаузального статуса пациента. Могут быть затруднения его определения у пациентов, только что получивших цитотоксическую химиотерапию, когда решается вопрос о назначении ингибиторов ароматазы. Эксперты настояли на обязательном подтверждении постменопаузального статуса до и во время применения ингибиторов ароматазы.
Другие факторы, характеризующие организм, сопутствующие заболевания, также важны при выборе лечения. Например, тромбоэмболия в анамнезе исключает применение тамоксифена. Наличие сопутствующей кардиальной патологии может повлиять на выбор определенных химиотерапевтических средств (антрациклины) или на возможность лечения трастузумабом. Возраст больной и сопутствующая патология могут ограничить применение более интенсивных режимов химиотерапии. Различные виды ожидаемых побочных эффектов могут повлиять на предпочтения пациентов от одной к другой лечебной стратегии.
Эндокринная терапия постменопаузальных больных
Хорошо доказанная высокая эффективность ингибиторов ароматазы третьего поколения (ИА) значительно облегчила выбор подходящего лечения после четверти века довольно успешного использования тамоксифена (Winer, 2005; Coates, 2007; Coombes, 2007; Goss, 2005; Howell, 2005; Jakesz, 2005). Тем не менее, большинство членов Панели полагает, что 5-летнее применение одного тамоксифена остается надежным адъювантным лечением для некоторых категорий больных. Среди стратегий использования ИА панель экспертов высказала явное предпочтение в пользу "последовательной" эндокринотерапии - переключение на ИА после 2-3 лет терапии тамоксифеном.
Существенное меньшинство Панели также поддержало первоначальное использование ИА. И очень небольшое число членов Панели высказались в пользу "проспективной" политики: 5-летнее применение тамоксифена с последующим применением ИА. Для больных уже закончивших 5-летнее лечение тамоксифеном Панель поддерживает последующее дополнительное использование ИА, но только у больных с регионарными метастазами. Первоначальное (up front) применение ИА более приемлемо у больных с высоким риском рецидива или с НЕR 2-позитивным РМЖ. Также целесообразно изначальное применение ИА у пациентов, получающих антидепрессанты класса SSRI.
Панель явно предпочла последовательное, но не одновременное назначение цитотоксической химиотерапии и эндокринотерапии. Общая продолжительность оптимальной адъювантной эндокринотерапии может колебаться от 5 до 10 лет.
Большинство экспертов считает необходимым проверять наличие супрессии овариальной функции у более "молодых" постменопаузальных женщин, хотя время и возраст для такой проверки остаются неясными.
Панель поддерживает необходимость оценки костно - минеральной плотности до назначения ИА и использование кальция и витамина D и, особенно, физических упражнений, снижающих риск костных потерь и симптомов, связанных с использованием ИА.
Эндокринотерапия у пременопаузальных больных
Панель экспертов единогласно приняла в качестве стандарта адъювантной эндокринотерапии пременопаузальных больных РМЖ или -
- назначение тамоксифена в сочетании с подавлением овариальной функции или
- лечение одним тамоксифеном.
Одна супрессия овариальной фукции считается возможной если больная планирует в будущем беременность хотя и отказ от одновременного лечения тамоксифеном не может быть полностью оправдан.
Панель подтверждает назначение гонадотропин-рилизинг гормона (ГРГ) аналога в качестве средства подавления овариальной функции. Значительное большинство экспертов считают хирургическую овариэктомию приемлемым методом. Метод «выключения» яичников зависит от типа заболевания и других обстоятельств. Облучение яичников с целью их подавления большинство экспертов отвергли. Важно знать, что у некоторых пациентов один ГРГ аналог может не полностью подавить овариальную функцию (Jimenz-Gordo, 2006).
Хотя оптимальная продолжительность подавления овариальной функции с помощью аналогов ГРГ остается неясной, все же большинство экспертов полагает, что такое лечение должно продолжаться в течение 5 лет, особенно у больных с ЭР+ РМЖ высокого риска рецидива и/или с HER2 (+) заболеванием (Mauriac, 2007).
Снова без достаточных доказательств большинство экспертов предлагают отложить применение ГРГ аналогов до завершения химиотерапии.
Использование ингибиторов ароматазы (ИА) в качестве единственного средства эндокринотерапии пременопаузальных больных РМЖ считается неприемлемым.
Применение ИА на фоне супрессии овариальной функции в настоящее время проверяется в клинических испытаниях.
А вне клинических испытаний такая комбинация (ИА+ГРГ-аналог) допускается при наличии противопоказаний к применению тамоксифена. Больные, которые были пременопаузальными к моменту установления диагноза, но стали постменопаузальными после химиотерапии или во время адъювантной эндокринотерапии, также могут получать ИА, но прекращение овариальной функции должно быть уточнено до и во время приема ИА, поскольку такое лечение обычно стимулирует эндокринно-овариальную функцию
(Barroso, 2006).
ХИМИОТЕРАПИЯ
Пожалуй, наиболее трудным вопросом при планировании современной адъювантной терапии является отбор пациентов с опухолями высоко или недостаточно эндокринночувствительными, которым кроме эндокринотерапии должна быть назначена и дополнительная химиотерапия. К признакам, свидетельствующим о сомнительной адекватности одной эндокринотерапии, относятся относительно низкая экспрессия рецепторов стероидных гормонов, метастатическое поражение регионарных лимфатических узлов, высокая степень злокачественности или высокий уровень "пролиферативных" маркеров, крупные размеры опухоли и обширная перитуморальная сосудистая инвазия. Предлагаемые молекулярно-генетические технологии (Oncotype DXTM, Mamma printTM) для облегчения выбора терапии не были поддержаны экспертами из-за того, что пока нет убедительных сведений их вклада в планирование терапевтических подходов.
Считается приемлемым широкий спектр химиотерапевтических режимов, но с малым согласием по конкретному "фавориту". Большинство экспертов поддерживает применение антрациклинов у всех пациентов, в том числе и при HER-положительных опухолях.
Панель экспертов считает целесообразным включать ДНК-повреждающие препараты у больных с "трижды негативными" опухолями (ЭР-, ПР-, НЕR2-) (James,2007). Комбинации циклофосфамида, 5-фторурацила и антрациклинов (CAF, CEF, FEC, FАС) пользуются широкой поддержкой Панели, также как и комбинация антрациклинов и циклофосфамида с последующим применением паклитаксела или доцетаксела. Лишь немногие члены Панели поддержали химиотерапию повышенной плотности (dose - dense), а высокодозную химиотерапию, требующую поддерживающего применения стволовых клеток периферической крови, категорически отвергли.
В целом Панель допускает применение "менее интенсивной" химиотерапии (4 курса по схеме АС или 6 курсов по схеме СМF) у больных с высоко эндокринночувствительными опухолями, но с высоким риском рецидива или у больных с недостаточно эндокринночувствительными опухолями и НЕR 2-негативным заболеванием. Другие режимы также считаются подходящими для этой группы пациентов, включая схему САF и комбинацию доцетаксела с АС (схема TAC).
Большинство членов Панели считает более короткую продолжительность химиотерапии (12 - 16 недель) подходящей для пожилых больных, а раннее начало такой терапии особенно важно для больных с рецептор-негативными опухолями (ЭР-/ПР-). При этом пожилым больным с достаточной ожидаемой продолжительностью жизни следует предлагать стандартную химиотерапию. Хотя члены Панели высоко оценивают значение гематопоэтических факторов у больных с фебрильной нейтропенией, лишь немногие из них поддерживают их рутинное применение. Сообщается о повышенном риске острого лейкоза у пожилых пациентов получавших гематопоэтические факторы (Hershman, 2007).
Однако эти сведения получены не из рандомизированных испытаний, а в проспективных исследованиях таких осложнений не отмечено.
В табл.3 кратко представлены рассмотренные выше лечебные подходы и концепции.
В 2007 г онкологи имели две терапевтические мишени для целенаправленной (таргетной) терапии: рецепторы стероидных гормонов (ЭР/ПР) и НЕR 2. В планировании лечения риск рецидива заболевания играет второстепенную роль, хотя и величина риска должна учитываться у больных с эндокринно чувствительными опухолями при определении показаний к дополнительной химиотерапии (до эндокринотерапии).
Больные с высокочувствительными к эндокринотерапии опухолями, особенно при отсутствии других неблагоприятных прогностических признаков (низкий и промежуточный риск рецидива, НЕR2-) могут успешно получать только эндокринотерапию, в то время как при высоком риске рецидива могут нуждаться в дополнительной химиотерапии.
Решения о дополнительной химиотерапии должны основываться на оценке степени эндокринной чувствительности опухоли, факторов риска, а также предпочтений самой больной. Эксперты подчеркивают, что не существует абсолютных правил при обосновании решения о лечении, которое остается предметом дискуссии между пациентом и лечащим врачом.
Предоперационная системная терапия
Клинически часто приходится встречаться со сложнейшим выбором лечения больных местнораспространенным РМЖ. Удельный вес таких опухолей колеблется от 5% до 40%. Обоснованиями для назначения неоадъювантной системной терапии МРРМЖ являются:
1. Высокая вероятность скрытого (микрометастатического) распространения.
2. Возможность сократить объем хирургического вмешательства в пределах «чистых» хирургических краев.
3. Возможность оценить клинический ответ на терапию in vivo.
4. Доступность точной патоморфологической оценки степени регрессии опухоли.
5. Возможность специальных исследований биопсийного опухолевого материала до, во время и после завершения первичного системного лечения.
Целями данного вида системного лечения являются:
1. Добиться регресса опухоли и провести радикальное местно-регионарное лечение.
2. С учетом крайне неблагоприятного прогноза у этой группы пациентов с помощью системной терапии добиться улучшения отдаленных результатов лечения.
Схема проведения неоадъювантного системного лечения:
Маммография, УЗИ, трепан-биопсия с определением уровня ЭР, ПР, Her 2/neu. 4 курса неоадъювантной химиотерапии - операция - 4 курса адъювантной химиотерапии. При отсутствии эффекта после 4 курсов неоадъювантной химиотерапии необходимо сменить схему химиотерапии.
Исходя из уже рутинного применения такого лечения при крупных опухолях, большинство членов Панели поддержали использование предоперационной системной терапии (включая химиотерапию и/или эндокринотерапию при ЭР+ опухолях) для улучшения хирургического лечения, в том числе органосохраняющего лечения РМЖ (Kaufmann, 2006; Semiglazov, 2007) Оценка величины ответа на неоадъювантное лечения может служить (по мнению некоторых членов Панели) основанием назначения такого же лечения и в адъювантных режимах. Большинство членов Панели поддержали также включение трастузумаба в программы предоперационного лечения больных с НЕR 2-положительным РМЖ.
Табл.1. Определение категорий риска у больных с операбельными формами РМЖ
. Сан-Галлен, 2007.
| Категория риска | |
| Низкий риск |
Отсутствие пораженных лимфоузлов (р NО) и все нижеследующие признаки: р Т ≤2 см и степень злокачественности (G 1) и Экспрессия ЭР и ПР и Нет повышенной экспрессии или амплификации HER 2/neu Возраст≥ 35 лет |
| Промежуточный риск |
Отсутствие пораженных лимфоузлов (р NО) и по крайней мере один из следующих признаков: р Т> 2 см или Наличие экстенсивной перитуморальной инвазии сосудов или Повышенная экспрессия или амплификация НЕR 2/neu Возраст < 35 лет |
|
Наличие одиночных регионарных метастазов (1-3 вовлеченных л/у) Экспрессия ЭР+ /ПР+ , Нет повышенной экспрессии или амплификации НЕR2/neu |
|
| Высокий риск |
Наличие одиночных регионарных метастазов (1-3 вовлеченных л/у и отсутствие экспрессии рецепторов стероидных гормонов (ЭР-ПР-) или |
| Наличие 4 и более пораженных лимфатических узлов |
Табл.2.Планирование адъювантного лечения рака молочной железы.
Сан-Галлен, 2007.
|
Высокочувствительные к эндокринотерапии |
Недостаточно эндокринно чувствительны |
Нечувствительные к эндокринотерапии |
|
| HER (-) |
Эндокринотерапия, дополнительно химиотерапия для группы высокого риска рецидива |
Эндокринотерапия, дополнительно химиотерапия для промежуточного и высокого риска рецидива |
Химиотерапия |
| HER (+++) |
Эндокринотерапия + трастузумаб+* Химиотерапия** |
Эндокринотерапия + Трастузумаб + Химиотерапия |
Трастузумаб + Химиотерапия |
*Трастузумаб (Герцептин®) не рассматривается как стандарт лечения у женщин с опухолями менее 1 см и без метастатических лимфоузлов (р NО), особенно у женщин с высоко эндокринночувствительльными опухолями.
**Имеющиеся данные клинических испытаний не позволяют рекомендовать трастузумаб без предшествующей или сопутствующей химиотерапии.
Табл.3. Адъювантное лечение в зависимости от терапевтических мишеней и категорий риска
. Сан-Галлен, 2007.
| HER 2 (-) | HER 2 (+++) | |||||||||||
|
Высокоч. эндокрин. чувствит. |
Неполн. чувств. к эндокрин. |
Нечувст. к эндокрин. терапии |
Высокоч. эндокрин. чувствит |
Неполн. чувств. к эндокрин. |
Нечувст. к эндокрин. терапии |
|||||||
| Низкий риск | э | э | э | э | ||||||||
|
Проме- жуточ- ный риск |
х→ |
х→ |
х→ ээ |
х→ ээ |
x | x |
х→ э+т |
х→ э+т |
х→ э+т |
х→ э+т |
х+т | х+т |
|
х→ |
х→ |
Х→ |
Х→ ЭЭ |
Х→ ЭЭ |
x |
х→ э+т |
х→ э+т |
х→ э+т |
х→ э+т |
х+т | х+т | |
| Высокий риск |
хэ |
хэ |
хэ |
хэ |
х+т | х+т | ||||||
|
х→э |
х→э | х→э | х→э | х | х |
х→ э+т |
х→ э+т |
х→ э+т |
х→ э+т |
х+т х+т |
х+т х+т |
|
Х- химиотерапия
Э- Эндокринотерапия
Т- трастузумаб (Герцептин)
Адъювантное лечение больных РМЖ в соответствие с чувствительностью к эндокринотерапии
ИА - ингибиторы ароматазы
ХТ - химиотерапия
Там - Тамоксифен
СОФ - супрессия овариальной функции (хирургическое, лучевая терапия,
Консервативная)
АС - антрациклин + циклофосфан
CEF, FEC - циклофосфан + эпирубицин + 5-фторурацил
CAF - антрациклин + циклофосфан + 5- фторурацил
Тах - таксаны
Let - летразол
Ехе - экземестан
Ana - анастразол
ЛЕЧЕНИЕ ПРИ РАЗЛИЧНЫХ СТАДИЯХ РМЖ
0, I стадия
1. Органосохраняющее лечение.
После органосохраняющей операции с учетом уровня экспрессии ЭР, ПР, Her-2/neu, назначается один из видов системного лечения. При отсутствии необходимости проведения системного лечения, возможно назначение лучевой терапии. Облучение молочной железы осуществляется с помощью фотонного излучения (6 МэВ) линейного ускорителя или гамма-излучения 60Со-установки (1,25 МэВ) с двух тангенциально расположенных полей, имеющих целью обеспечить максимально гомогенное облучение железы. РОД 2 Гр, СОД 60 Гр. Послеоперационная зона дополнительно облучается в дозе 12 Гр (по 2 Гр). Предпочтительно облучение электронным пуском.
2. Радикальная мастэктомия.
При всех вышеперечисленных локализациях I стадии заболевания возможно выполнение радикальной мастэктомии с восстановлением формы железы или без восстановления (по желанию пациентки).
Системное лечение предусматривает: химиотерапию у больных до 50 лет при инвазивных формах, гормонотерапию тамоксифеном у постменопаузальных больных с рецептор положительными опухолями в течение 5 лет. Больным младше 50 лет с сохраненной менструальной функцией: двухсторонняя овариэктомия или LHRH-аналоги ежемесячно в течение 2 лет на фоне приема тамоксифена.
Больным с отрицательными ЕР, ПР - ПХТ (CMF или CAF) гормонотерапия не проводится.
Схемы химиотерапии при 0 и I стадиях:
CMF Bonadonna regimen
Метотрексат 40 мг/м*2 в/в 1 дн.
5ФУ 600 мг/м*2 в/в 1 дн.
Повторять каждые 3 недели 6 циклов
Циклофосфан 100 мг/м*2 перорально 1-14 дн.
5ФУ 600мг/м*2 в/в 1 и 8 дн.
Преднизолон 40 мг/м*2 перорально 1и 14 дн.
Повторять каждые 4 недели 6 циклов.
Доксорубицин 60мг/м*2 в/в 1 дн.
Циклофосфан 600мг/м*2 в/в 1 дн.
II стадия
Лечение, идентичное таковому при I стадии, однако у больных с N0, но с наличием неблагоприятных прогностических признаков (возраст до 35 лет, отрицательные гормональные рецепторы, положительный Her 2-neu статус) в послеоперационном периоде, кроме всей молочной железы, при локализации опухоли во внутренних квадрантах или центральной зоне, а также у всех больных с N+ (при метастатическом поражении трех и менее подмышечных лимфатических узлов) дополнительно облучаются парастернальная и надключичная зоны со стороны основного очага.
Послеоперационная ЛТ проводится в режиме классического фракционирования дозы (РОД 2 Гр, СОД 30 Гр) после выполнения органосохраняющей операции и проведения системной терапии. Послеоперационная зона дополнительно облучается в дозе 12 Гр (по 2 Гр).
У больных с N+ при поражении четырех и более подмышечных лимфатических узлов и/или при прорастании опухолью капсулы лимфатического узла, кроме оставшейся молочной железы, облучается парастернальная, надподключично-подмышечная зона со стороны поражения.
ВСЕ пациенты со II стадией должны получать адъювантную системную химиотерапию (CMF, AC, ТАС, АС+Т, FAC, CАF, FЕC, А+ CMF).
При +ER тамоксифен в течение 5 лет.
При -ER - химиотерапия.
Больным с положительным Her 2-neu - трастузумаб по 8 мг/кг в 1 день, каждый 21 день по 4 мг\кг
Схемы химиотерапии:
циклофосфан 100 мг/м*2 перорально 1-14 дн.
5ФУ 600 мг/м*2 в/в 1 и 8 дн.
повторять каждые 28 дн.
метотрексат 40 мг/м*2 в/в 1 и 8 дн.
5ФУ 600мг/м*2 в/в 1 и 8 дн.
повторять каждые 28 дн.
повторять каждые 21-28 дн.
5ФУ 500 мг/м*2 в/в 1 и 8 дн.
доксорубицин 50 мг/м*2 в/в длительная инфузия 72 часа 1-3 дн.
циклофосфан 500 мг/м*2 в/в 1 дн.
повторять 21, если восстановлены гематологические показатели.
Таксотер 75 мг/м*2 в/в 1 дн.
Доксорубицин 50 мг/м*2 в/в 1дн.
Циклофосфан 500 мг/м*2 в/в 1 дн.
повторять каждые 21 дн.
Циклофосфан 600 мг/м*2 в/в 1дн.
5ФУ 600 мг/м*2 в/в 1дн.
Повторять каждые 21-28 дн.
Доксорубицин 60 мг/м*2 в/в 1 дн.
Циклофосфан 600 мг/м*2 в/в 1 дн.
Повторять каждые 3-4 недели в зависимости от восстановления гематологических показателей.
доксорубицин 60 мг/м*2 в/в 1дн.
циклофосфан 600 мг/м*2 в/в 1 дн. Х 4 цикла.
продолжать паклитаксел 175 мг/м*2 в/в в тчение 3-х часовой инфузии 1 раз в 3 недели 4 цикла.
Доксорубицин 60 мг/м*2 в/в 1дн.
Циклофосфан 600 мг/м*2 в/в 1 дн Х 4 цикла.
Продолжать доцетаксел 75 мг/м*2 в/в 1 раз в 3 недели 4 цикла.
Циклофосфан 75 мг/м*2 перорально 1-14 дн.
Эпирубицин 60 мг/м*2 в/в 1 дн.
5ФУ 500 мг/м*2 в/в 1 и 8 дн. каждый месяц 6 циклов.
Доксорубицин 75 мг/м*2 в/в 1 дн каждые 3 недели 4 цикла.
Циклофосфан 600 мг/м*2 в/в 1дн.
Метотрексат 40 мг/м*2 в/в 1 и 8 дн.
5ФУ 600 мг/м*2 в/в 1 и 8 дн.
Каждые 3 недели повторять 8 циклов.
При IIА стадии общие воздействия назначают в соответствии с табл. 4.
Таблица 4. Отсутствие метастазов в подмышечных лимфатических узлах
|
Менструальный статус |
Низкий риск |
Промежуточный и высокий риск |
|
Гормоночувствительные опухоли |
||
|
Менструирующие |
Тамоксифен золадекс или диферелин |
Химиотерапия химиотерапия + тамоксифен (при выключении функции яичников) |
|
Постменопауза |
Тамоксифен ИА |
Тамоксифен или химиотерапия + Тамоксифен или ИА |
|
Гормонорезистентные опухоли |
||
|
Менструирующие |
Химиотерапия |
|
|
Постменопауза |
Химиотерапия |
|
Больным с положительным Her 2-neu - трастузумаб по 8 мг/кг в 1 день, каждый 21 день по 4 мг\кг в течение 1 года. У больных репродуктивного возраста с ЭР (-) и ПР(-) статусом в сочетании с ПХТ (таксаны или СМF, исключая антрациклины). У пациенток постменопаузального возраста с ЭР(+) и ПР(+) статусом в сочетании с ИА, при ЭР (-) и ПР(-) статусе необходимо проводить терапию в сочетании с ПХТ (таксаны или СМF, исключая антрациклины).
У женщин в пременопаузе при наличии 8 и более метастатических лимфатических узлов после завершения 6 курсов ПХТ и продолжающейся менструальной функции показано выполнение двусторонней овариэктомии или выключение функции яичников назначением агонистов релизинг-гормона ЛГГ (гизерелин - 3,6 мг подкожно в области брюшной стенки каждые 28 дней в течение 2 лет, трипторелин по 3,75 мг каждые 28 дней в течение 2 лет) на фоне приема тамоксифена по 20 мг в сутки в течение 5 лет. При прекращении менструальной функции после 6 курсов ПХТ назначают тамоксифен по 20 мг в сутки в течение 5 лет.

Больным с положительным Her 2-neu - трастузумаб по 8 мг/кг в 1 день, каждый 21 день по 4 мг\кг, в течение 1 года. У больных репродуктивного возраста с ЭР (-) и ПР(-) статусом в сочетании с ПХТ (таксаны или СМF, исключая антрациклины). У пациенток постменопаузального возраста с ЭР(+) и ПР(+) статусом в сочетании с ИА, при ЭР (-) и ПР(-) статусе необходимо проводить терапию в сочетании с ПХТ (таксаны или СМF, исключая антрациклины).
Оперативное вмешательство через 3 недели после окончания лечения в объеме РМЭ по Мадену, радикальной резекции молочной железы, органосохраняющей или реконструктивно-пластической операции.
Оперативное лечение
. Оперативное пособие выполняется по общепринятой методике в объеме радикальной мастэктомии (по Madden, Patey). Объем хирургического вмешательства (вариант мастэктомии) определяется распространенностью опухолевого процесса. Во всех случаях показано удаление регионарных лимфатических узлов трех уровней: подмышечных, подключичных, подлопаточных с их последующей маркировкой. Опухоль подлежит маркировке в соответствии с размерами и локализацией по квадрантам молочной железы.
Возможно одномоментное или отсроченное выполнение реконструктивно-восстановительной операции (по желанию пациентки).
Послеоперационная лучевая терапия
. Послеоперационная ЛТ проводится в режиме классического фракционирования дозы (РОД 2 Гр, СОД до эквивалентной дозы 60 Гр). Поля облучения: надподключичное, подмышечное, парастернальное, грудная стенка (при рТ3, 4).
61. Эритроцитарная масса
цитологическая или гистологическая верификация диагноза, общий анализ крови (6 показателей), общий анализ мочи, кровь на б/химию (9 показателей), кровь на коагулограмму, электрокардиография, флюоро-гра-фия или R-графия легких, УЗИ молочных желез, регионарных зон, печени, органов малого таза, маммография. Дуктография, магнитно-резонансная томография, компьютерная томография молочных желез, определение уровня гормонов (ЭР -, ЭР +, Her-2-neu), апоптоз, СА15-3 по возможности и по показаниям.
Информация
Источники и литература
- Протоколы диагностики и лечения заболеваний МЗ РК (Приказ №764 от 28.12.2007)
- 1. В.Ф. Семиглазов, В.В. Семиглазов, К.Ш. Нургазиев. Обоснование стандартов лечения рака молочной железы., 362 стр., Алматы, 2007г. 1. Barroso G,Menqcal g. Felix H. Roias-Ruis J.C. et al. Comparison of the efficacy of the aromatase inhibitor letrozole and clomiphene citrate as adjuvants to recombinant folliclestimulating hormone in controlled ovarian hyperstimulation: a prospective, randomized, blinded clinical trial. //Fertil Steril .- 2006.- Vol 86p.1428-1431 2. Bogaerts J, Cardoso F, Buyse M, et al. Gene signature evaluation as a prognostic tool: challenges in the design of the MINDACT trial.//Nat Clin Pract Oncol .-2006.- Vol .3: p.540-551 3. Clarke CA, Glaser SL. Recent declines in hormone therapy utilization and breast cancer incidence: clinical and population-based evidence. // J Clin Oncol.- 2006 .-Vol.24.p 49 4. Coates AS, Keshaviah A, fthurlimann B, et al. Five years of letrozole compared with tamoxifen as initial adjuvant therapy for postmenopausal women with endocrine-responsive early breast cancer: update of study BIG 1-98// J Clin Oncol .-2007 -Vol. 25 p.486-492 5. Colleoni M, Rotrnensz N, Peruzzotti G, et al. Prognostic role of the extent of peritumoral vascular invasion in-operable breast cancer. Ann Oncol .-2007 (accepted for publication) 6. Coombes RC, Kilburn LS, Snowdon CF, et al. Survival and safety of exemestane versus tamoxifen after 2-3 years" tamoxifen treatment (Intergroup Exemestane Study): a randomised controlled trial. // Lancet.- 2007.- Vol.349.p.1110-1117 7. Goldhirsch A, Glick JH, Gelber RD et al. Meeting highlights: international expert consensus on the primary therapy of early breast cancer.//Ann Oncol.-2005.-Vol.16.p.1569-1583 8. Goldhirsch A; Cda^es AS, Qelber RD et al. First-select the target: better choice of adjuvant treatments for breast cancer patients. //Ann Oncol.-2006.-Vol. 17 p.1772-1776 9. Goss PE, Ingle JNJ Martino S, et al. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17. // JNCI Cancer Spectrum.-2005.- Vol.97.p.1262-1271 10. Howell A, Cuzick J, Baum M, et al. Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years" adjuvant treatment for breast cancer. // Lancet.- 2005.- Vol 365.p.60-62 11. Jakesz R, Jonat W, Gnant M, et al. Switching of postmenopausal women with endocrineresponsive early breast cancer to anastrozole after 2 years" adjuvant tamoxifen: combined results of ABCSG trial 8 and ARNO 95 trial. // Lancet.- 2005.- Vol 366.p.455-462 12. James CR, Ouinn JE, Mullan PB et al. BRCA1, a Potential predictive biomarker in the treatment of breast cancer //Oncologist.-2007.-Vol 2.p. 142-150 13. Jimenez-Gordo AM. De Las Heras B. Zamora P. et al.: Failure of Goserelin ovarian* ablation in premenopausal women with breast cancer: two case reports. //Gynecol Oncol .- 2000. - Vol 76 p.126-127 14. Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. // N Engl J Med .- 2006.- Vol 354. p.809-820 15. Kaufmann M, Hortobigyi GN, Goldhirsch A, : et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: an update// J Clin Oncol .- 2006.-Vol 24p.1940-1949 16. Korreman SS. Pedefsen AN. Aarup LR et"al. Reduction of cardiac and pulmonary complication probabilities after breathingadapted radiotehrapv for breast cancer. Int J Radiot //Oncol Biol Phvs .-2006.- Vol 65.p.1375-1380 17. Kurtz J. EUSOMA Working Party. The curative role of radiotherapy in the treatment of operable breast cancer. //Eur J Cancer.-2002.- Vol 38.p.1961-1974 18. Mauriac L, Keshaviah A. Debled M Mouridsen H et al. Jtedictors of early relapse in postmenopausal women with hormone receptor-positive breast cancer in the BIG 1-98 trial//Ann Oncol.- 2007.- Vol. 14 p.320-327 19. Perez EA. Combining adjuvant chemotherapy with biological therapy. St. Gallen. .- //Breast.-2007 .- Vol.16 (Suppl): p105-111 20. Piccart-Gebhart MJ, Procter M, Leyland-Jones В et al. Trastuzumab after Adjuvant Chemotherapy in HER2-Positive Breast Cancer. //N Engl J Medi -2005.-Vol.353p.1659-1672, 21. Recht A. Edge SB. Splin LJ. Robinson PSet al. Postmastectomy radiotherapy:" clinical practice guidelines of,the American Society of Clinical Oncology//. J Clin Oncology.- 2001 - Vol 19.p.1539-69 22. Regan MM, Viale G, Mastropasqua MG, et al. Re-evaluating adjuvant breast cancer trials: assessing hormone receptor status by immunohistochemical versus extraction assays. //JNCI Cancer Spectrum.-2006-Vol. 98 p.1571-1581 23. Romond EH, Perez EA, Bryant J et al. Trastuzumab plus Adjuvant Chemotherapy for Operable HER2-Positive Breast Cancer. // N Engl J Med.-2005.-Vol. 353 p.1673-1684 24. Semiglazov V.F., Semiglazov V.V. Dashyan G.A. et.al. Phase 2 Randomized trial of primary endocrine therapy versus chemotherapy in postmenopausal patients with estrogen receptor-positive breast cancer// Cancer.-2007-Vol 110.-p. 244-254 25. Slamon D, BCIRG 006 II interim analysis. San Antonio Breast Cancer Symposium, 2006. http://www.bcirg.org/Internet/BCIRG+at+SABCS+2006/default.htm 26. Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets. // Proc Natl Acad Sci U S A .- 2003.- Vol.100p.8418- 8423 27. Sorlie T., Perou CM, Tibshirani R et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. // Proc Natl Acad Sci U S A .-2001.- Vol. 98 p. 10869-10874 28. Sparano JA. TAILOR: trial assigning individualized options for treatment. // Clin Breast Cancer.- 2006.- Vol.7:p347-350 29. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. //J Clin Oncol.- 2005.- Vol 23: p.619-629. 30. Wolff AC, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer// Arch Pathol Lab Med.-2007.- Vol.131p.18.
Информация
Мухамбетов С.М., НЦ онкологии
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.
Основной причиной кожных нарушений при аллергической крапивнице является массовая дегрануляция тканевых базофилов (тучных клеток). В состав гранул этих клеток входят гистамин, гепарин, лейкотриены и целый ряд других биологически активных соединений, способных значительно изменять метаболические процессы в тканях. В основном они приводят к расширению кровеносных сосудов, увеличивают проницаемость их стенки, вызывают накопление тканевой жидкости, стимулируют болевые рецепторы кожи, что приводит к появлению зуда. В большинстве случаев такие реакции при аллергической крапивнице имеют местный характер и поражают только определенный участок кожи или, реже - всю поверхность тела. Однако иногда столь массовый выброс активных соединений может привести к общим реакциям по типу анафилактического шока и отека Квинке.
Причины, которые вызывают дегрануляцию тучных клеток, отличаются у различных форм аллергической крапивницы. Обычно это реагиновый тип гиперчувствительности (аллергия 1-го типа), опосредованный иммуноглобулинами типа Е. Аллергенами при данном виде аллергической крапивницы являются компоненты пищи, пыльца растений, бытовая пыль, некоторые лекарственные средства и другие факторы. В таком случае кожные проявления выступают всего лишь одним из симптомов пищевой или другой аллергии. В некоторых случаях вызвать такие кожные нарушения может и аллергия 2-го типа – в основном это бывает при переливаниях крови. Внутривенное введение некоторых лекарственных средств с развитием иммунокомплексной реакции непереносимости также может вызвать аллергическую крапивницу.
Замечено, что некоторые инфекционные заболевания, эндокринные нарушения, нарушения психо-эмоциональной сферы повышают вероятность развития аллергической крапивницы. Особенно это актуально в отношении идиопатической, или хронической формы патологии. Патогенез развития кожных нарушений в этом случае изучен слабо, предполагаются как иммунные, так и неиммунные механизмы активации тканевых базофилов кожи. Поэтому при наличии аллергической крапивницы неуточненной этиологии производят полное обследование организма больного с целью выявления скрытых и хронических заболеваний и нарушений.
При псевдоаллергической крапивнице патогенез во многом схожий – происходит массовая активация тканевых базофилов кожи с выделением биологически активных соединений. Однако причины и механизмы этого процесса несколько иные – это может быть врожденная или приобретенная нестабильность мембран тучных клеток, их аномальная реакция на различные физические или гуморальные факторы. Кроме того, в ряде случаев псевдоаллергической крапивницы, у больного обнаруживается повышенная чувствительность тканей кожи к гистамину и другим компонентам гранул базофилов. Поэтому даже незначительное выделение этих веществ может привести к клинической картине крапивницы.
Определение. Заболевание, ведущим признаком которого является снижение числа эритроцитов менее 4,0х10 12 /л и гемоглобина менее 120 г/л при цветовом показателе ниже 0,8 и уровне сывороточного железа менее 13 мкмоль/л.
Статистика. Одна из самых распространенных болезней человека. Поражено до 25% всего населения, 40% женщин детородного возраста, 33% лиц обоего пола старше 60 лет.
Этиология.
Хронические кровопотери, превышающие ре
генераторные возможности организма:
Меноррагии (менструации длительностью
6-7 дней, обильные; либо со сгустками -
любой длительности);
Геморроидальные кровотечения;
Желудочно-кишечные кровотечения при
эрозивных и язвенных поражениях.
Хронические заболевания желудочно-кишеч
ного тракта, особенно при пониженной сек
реторной функции желудка, приводящие к на
рушению всасывания пищевого железа.
Недостаточное питание (голодание, анорексия
и др.)
Гипер- и гипотиреоидные состояния.
Беременность, лактация, ранний детский воз
раст.
Длительный неконтролируемый прием некото
рых медикаментов, особенно нестероидных
противовоспалительных препаратов (ибупро-
фен, диклофенак и др.), анальгина, бисептола.
Клиника, диагностика. У женщин заболевание часто протекает с синдромом хлороза. Жалобы на обморочные состояния, субфебрилитет, боль в языке, извращение вкуса и обоняния; непреодолимое
желание есть мел, известку, глину, землю, побелку со стен, нравятся тяжелые пряные ароматы. Ломкость ногтей и волос. Ногти на вид уплощенные, на ощупь мягкие, слоистые. Волосы сухие, секущиеся, тусклые. У мужчин болезнь протекает всегда без синдрома хлороза. Бледность кожи, иногда с зеленоватым оттенком. Тоны сердца глуховаты, нежный систолический шум на всех точках. Тахикардия, гипотония. Нервная система - признаки астенодепрессивного, астеноневротического, астеноипохондрического синдромов. Лабораторные показатели: снижение количества эритроцитов, гемоглобина, цветового показателя, сывороточного железа, увеличение СОЭ, ани-зоцитоз, пойкилоцитоз эритроцитов.
Классификация. Уточняются степень тяжести, этиологический фактор, фаза болезни (обострение, ремиссия).
По тяжести анемия:
Легкая (эритроцитов 3,0-3,5х10 |2 /л, НЬ 100 г/л
и выше);
Средней тяжести (эритроцитов 2,0-3,0х10 |2 /л,
НЬ 80-100 г/л);
Тяжелая (эритроцитов 1,0-2,0x10"7л, НЬ 55-
80 г/л);
Крайне тяжелая, угрожающая развитием
анемической комы (эритроцитов <1,0х10 12 /л, НЬ
<55 г/л).
Критерии обострения: снижение цифр эритроцитов и НЬ у женщин ниже 4,0х10" 2 /л и 120 г/л, у мужчин ниже 4,5х10 12 /л и 130 г/л соответственно.
Критерий ремиссии: возвращение цифр эритроцитов и НЬ к нормальным значениям. Любое повышение цифр красной крови, не достигающее нормы, следует считать не ремиссией, а улучшением.
Амбулаторная гематология
Формулировка диагноза.
вследствие меноррагий, средней тяжести, обо
стрение.
Хроническая железодефицитная анемия сме
шанного генеза вследствие меноррагий и гас
трогенная, тяжелая, обострение.
Психологический, социальный статус форму
лируются по общим принципам.
Дифференциальная диагностика
Для исключения гемобластоза
следует убе
диться в отсутствии геморрагического и язвенно-не
кротического синдромов, лабораторно - в отсутствии
в лейкограмме больного изменений, характерных для
лейкозов.
Для исключения онкологической патологии
проводится скрининг первого уровня: крупнокадро
вая флюорография (ККФ), рентгеноскопия желудоч
но-кишечного тракта или фиброгастродуоденоскопия
(ФГДС), для женщин обязателен осмотр гинеколога.
Если при сборе анамнеза не выявлен источник, нет
указаний на заболевания желудочно-кишечного трак
та, больной пожилого возраста, то дополнительно для
исключения злокачественного новообразования про
водится рентгенография органов грудной клетки, ир-
ригоскопия, ректороманоскопия, ультразвуковое ис
следование (УЗИ) органов брюшной полости.
Витамин В 12 - и фолиеводефицитная анемия
гиперхромная, количество ретикулопитов снижено,
сывороточное железо в норме, часто встречается уве
личение печени, в стернальном пунктате мегало-
бластное кроветворение.
При гемолитической анемии:
иктеричность
кожных покровов, увеличение селезенки и печени,
лабораторно - анемия нормохромная, резкое повы
шение количества ретикулоцитов, сывороточное же
лезо в норме или повышено, гипербилирубин ем и я
за счет непрямого билирубина, в моче гемосидерин,
в пунктате костного мозга выраженная гиперплазия
эритроидного ростка.
При гипопластической анемии
геморраги
ческий и (или) гнойно-некротический синдром, рез
кое снижение всех показателей крови (эритроцитов,
лейкоцитов, тромбоцитов), в пунктате угнетение всех
ростков кроветворения.
Сидероахрестические анемии
по клинике
и данным общего анализа крови ничем не отлича
ются от железодефицитных, но содержание желе
за в
сыворотке крови таких больных высокое (50-
90 мкмоль/л). Лечение препаратами железа при
водит к гемосидерозу органов, не купируя симп
томов болезни.
Ведение пациента
Цель лечения: выздоровление (полная клини-ко-гематологическая ремиссия в течение 5 лет). Задачи:
Восстановление нормальных показателей
красной крови и сывороточного железа;
Поддержание нормальных показателей на
должном уровне.
Организация лечения. Большинство больных лечатся амбулаторно, кроме случаев тяжелых или этиологически неясной железодефицитной анемии. В таких случаях пациенты госпитализируются, исходя из принципа наиболее вероятной природы анемии, в гинекологическое, гастроэнтерологическое или другие отделения.
Мониторинг лечения. В период первого выявления или обострения болезни кровь контролируется 1 раз в 10-14 дней, такой же должна быть частота врачебных осмотров. Рассчитывать на увеличение цифр эритроцитов и гемоглобина через 3-5 дней не следует.
В период частичной ремиссии, когда пациент трудоспособен, но гематологическая норма не достигнута, контроль крови и врачебный осмотр проводятся ежемесячно. В период полной ремиссии при нормальном составе красной крови наблюдение осуществляется в течение первого года ежеквартально, затем 1 раз в 6 мес. Выздоровлением считается отсутствие обострений в течение 5 лет. Консультация гематолога в период обострения - 1 раз в 2 мес, затем 1 раз в 4-6 мес.
Плановая терапия
Информация для пациента и его семьи:
Причина развития анемии у данного пациента.
Принципиальная излечимость заболевания.
Сроки медикаментозной терапии (начальный
курс железотерапии - 2-3 мес, полный курс - до
1 года).
Возможность самоконтроля (нормы красной
крови и сывороточного железа).
Разъяснение вреда для данной категории па
циентов неквалифицированного лечения, вегетари
анства, постов, «рецептов» самолечения.
Советы пациенту и его семье:
Начинать лечение препаратами железа с
момента выявления заболевания, за исключени
ем самых начальных стадий, когда эритроцитов
>3,5х10 |2 /л, а НЬ >П0 г/л. В этих случаях можно
использовать дието- и фитотерапию как самостоя
тельный метод, однако в случае его неэффективно
сти в течение 1 мес. надо убедить пациента в необ
ходимости медикаментозной терапии.
Хроническая железодефицитная анемия
По возможности устранить этиологические
факторы: применять гемостатическую фитотерапию
в случае меноррагий; провести лечение хронических
заболеваний желудочно-кишечного тракта, почек;
убедить пациента (тку) в необходимости хирургичес
кого лечения геморроя или фибромиомы матки при
упорных кровотечениях.
Организовать лечебное питание с преоблада
нием мясных продуктов и естественных источни
ков витаминов (черная смородина, лимоны, обле
пиха). Женщинам с обильными месячными - грана
ты и орехи.
Исключить хронические бытовые, професси
ональные и, по возможности, медикаментозные ин
токсикации на период лечения (бензин, красители,
нестероидные противовоспалительные препараты,
бисептол).
Медикаментозная терапия
Препараты железа следует назначать в достаточных дозах и на длительный срок. Вследствие низкой эффективности и выраженных побочных эффектов не следует назначать: железо восстановленное, сироп алоэ с железом, гемостимулин, фер-рамид. Пищевые добавки, содержащие железо, для терапевтических целей непригодны, поскольку содержание железа в них не выше 18 мг, при потребности не менее 250 мг/сут. Их использование возможно только в период полной ремиссии для профилактики рецидивов.
Тардиферон (гипотардиферон для беременных). Назначается по 1-2 табл. в сутки, строго после еды. Содержит мукопротеазу, защищающую слизистую оболочку желудка, имеет высокую биодоступность. Гипотардиферон содержит необходимую беременным фолиевую кислоту.
Сорбифер. Назначается по 1 табл. 2 раза в день, после еды. Хорошо переносится, содержит аскорбиновую кислоту, облегчающую всасывание препарата.
Актиферрин. Назначается в зависимости от тяжести анемии от 1 до 3 капс, в сутки. Существуют формы для детей: сироп и капли. Препарат высокоэффективен, но возможна индивидуальная непереносимость.
Ферроплекс. Назначается по 2 табл. 4 раза в день. В сравнении с вышеописанными ретард-формами малоэффективен, но прекрасно переносится, почти не дает побочных эффектов. Возможно назначение при анемиях беременных.
NB! Предупредите пациента об изменении цвета кала на черный и о том, что все без исключения препараты железа принимаются строго после еды, невзирая на инструкции заводов-изготовителей.
Парентеральное применение железа (препарат феррумлек) исчерпывается двумя ситуациями:
Полная непереносимость пероральных препа
ратов;
Необходимость быстро и ненадолго стабили
зировать цифры красной крови, например, при
подготовке к срочной операции. Может вызы
вать анафилактические реакции, гиперкоагу
ляцию. В амбулаторных условиях назначает
ся только внутримышечно, инъекции (содер
жимое одной ампулы) проводятся через день,
курс 10-15 инъекций.
Вспомогательные лекарственные средства
Для улучшения всасывания железа и стимуляции эритропоэза - поливитаминные препараты с добавлением микроэлементов: компливит по 1 табл. в день, во время еды.
Для коррекции обмена белков - оротат калия по 1 табл. (0,5 г) 3 раза в день в течение 20 дней. Назначение витаминов группы В в инъекционной форме не оправдано.
Фитотерапия. Отвар шиповника. Ягоды измельчить и залить крутым кипятком из расчета 1 стакан кипятка на 1 ст. л. ягод, настаивать 20-30 мин. Выпить в течение дня.
Противоанемический сбор. Крапиву, череду, лист смородины, лист земляники смешать поровну, залить холодной водой (1 стакан воды на 1 ст. л. смеси) на 2-3 ч, затем поставить на огонь, кипятить 5-7 мин, остудить, процедить. Выпить в течение дня.
Примерная схема лечения железодефицитной анемии беременных:
Гипотардиферон по 1 табл. утром и вечером
после еды; прегнавит по 1 капс. 2 раза в день, оротат
калия по 1 табл. (0,5 г) 3 раза в день в течение
20 дней; фитотерапия; диетотерапия.
Примерная схема лечения железодефицитной анемии у пожилых:
Сорбифер по 1 табл. утром и вечером после
еды; ундевит по 1 драже 2 раза в день, оротат калия
по 1 табл. (0,5 г) 3 раза в день в течение 20 дней;
фитотерапия, диетотерапия.
Реабилитационная терапия
В период частичной ремиссии, когда больной трудоспособен, до нормализации цифр гемоглобина следует продолжать ежедневный прием препаратов. Когда количество гемоглобина достигает 120 г/л, назначается прием одного из препаратов железа в течение 7 дней после менструации или 7 дней каждого месяца, до года.
В период полной ремиссии, когда цифры гемоглобина нормальные без лечения, одномесячные про-тиворецидивные курсы ферроплекса или тардиферо-на весной и осенью.
Амбулаторная гематология
Критерии эффективности реабилитационной терапии: сохранение нормальных цифр красной крови и сывороточного железа в течение трех лет при проведении одномесячных противорецидивных курсов лечения весной и осенью.
Медицинская экспертиза
Экспертиза временной нетрудоспособнос
ти.
Сроки трудопотерь определяются медицинским
(клиника, цифры эритроцитов и гемоглобина) и со
циальным фактором - характером труда пациента.
При тяжелом физическом труде и на вредных произ
водствах у мужчин трудоспособность восстанавли
вается при цифрах гемоглобина 130 г/л, у женщин -
120 г/л. При легком физическом труде допускаются
цифры гемоглобина на 10 г/л, у лиц умственного тру
да - на 20 г/л ниже приведенных.
Медико-социальная экспертиза.
На МСЭК
направляются пациенты с тяжелой, трудно корриги
руемой анемией. В диагностической формулировке
анемия занимает место симптома или осложнения
основного заболевания.
Военно-врачебная экспертиза.
При анемии
(согласно ст. 11), быстро или медленно прогресси-
рующей со значительными изменениями состава крови и периодическими обострениями, призывники считаются негодными к несению военной службы, при анемии, сопровождающейся умеренным нарушением функции кроветворной системы и редкими обострениями, - ограниченно годными.
Предварительные и периодические медицинские осмотры. Согласно медицинским противопоказаниям (в дополнение к общим медицинским противопоказаниям) лица, страдающие анемией, не должны допускаться к работе в контакте со свинцом (1.25.1), ароматическими углеводородами (1.33), нафталином, нафтолами (1.34), хлорорганическими пестицидами (2.2.1), фторорганическими пестицидами (2.2.2), производными карбаминовых кислот (2.2.4), производными хлорбензойной кислоты (2.2.6), производными хлорфеноксиуксусной кислоты (2.2.7), производными хлорфеноксимасляной кислоты (2.2.8), галоидозамещенными анилидами карбоновых кислот (2.2.9), производными мочевины и гуаниди-на (2.2.10), полистиролами (2.4.7), противоопухолевыми препаратами (2.7.2), ионизирующим излучением (5.1).
Витамин В 12 - и фолиеводефицитные анемии (шифр Д 51.9)
Определение. Анемии, связанные с нарушением синтеза ДНК и РНК, обусловленным дефицитом витамина В ]2 или фолиевой кислоты и проявляющиеся мегалобластным кроветворением, гиперхроми-ей и макроцитозом эритроцитов. Сочетанный дефицит витамина В 12 и фолиевой кислоты встречается редко, но формы с изолированным дефицитом того и другого фактора клинически и лабораторно неразличимы, поэтому рассматриваются вместе.
Статистика. В России частота заболевания (20-60 случаев на 100000 населения) значительно колеблется в зависимости от региона: чаще болеют северяне, реже жители средней полосы, совсем редко - дальневосточники. Начиная с возраста 45-55 лет, в старших возрастных группах заболеваемость прогрессивно увеличивается. Достоверных различий в патологической пораженности, обусловленных половыми различиями, не выявлено.
Этиология и патогенез. Мегалобластные анемии рассматриваются как результат генетического дефекта, вызывающего иммунологическое нарушение, проявляющееся выработкой аутоантител против клеток желудочного эпителия. Это приводит к дегенеративным поражениям слизистых оболочек пищеварительного тракта в связи с недостаточным всасыванием витамина В 12 и (или) фолиевой кислоты. Дефицит витамина В |2 - причина тяжелого поражения спинного мозга (фуникулярный миелоз).
Клиника. Болеют, как правило, лица пожилого возраста. Общая слабость, изменение окраски кожи (бледность с желтушным оттенком), боли в языке и повышение вкусовой чувствительности до неприятных ощущений, онемение стоп и ладоней. В анамнезе указания на хронический гастрит, колит и другие заболевания желудочно-кишечного тракта. При осмотре больные «более желтушные, чем бледные», на языке участки ярко-красного цвета. При пальпации живота может выявляться болезненность в эпи-гастральной области, в подреберьях, по ходу кишечника при наличии хронических заболеваний желудочно-кишечного тракта. Анализ крови: гиперхром-ная макроцитарная анемия, обычно значительная. Цветовой показатель может повышаться до 1,3. Количество ретикулоцитов снижено, количество лейкоцитов - тоже, за счет нейтрофилов. Иногда наблю-
24. Денисов
дается значительная тр ом боцито пения без явлений кровоточивости. Умеренная гипербилирубинемия (до 28-47 мкмоль/л) за счет непрямого билирубина. Содержание железа в сыворотке крови нормальное или несколько повышено. Стериальный пунктат -мегалобластическое кроветворение.
Формулировка диагноза. Витамин В |2 -дефи-цитная анемия средней тяжести.
Дифференциальная диагностика
В первую очередь необходимо исключить он
кологическое заболевание. Для этого проводят
скрининг первого уровня: ККФ, рентгеноскопию же
лудка или ФГДС, для женщин - осмотр гинеколога,
для лиц старше 50 лет - ирригоскопию и УЗИ орга
нов брюшной полости.
Как синдром гиперхромная анемия встреча
ется при остром эритромиелозе.
Для исключения
этого заболевания надо убедиться в отсутствии ге
моррагического и гнойно-некротического синдро
мов, а также, поскольку при этом гемобластозе бла-
стные клетки в периферической крови появляются
не сразу, больному следует произвести стернальную
пункцию.
При железодефицитной анемии
в отличие от
витамин В 12 -дефицитной - бледность кожи с серо-
зеленоватым оттенком, наличие синдрома хлороза (у
женщин). Лабораторно: цветовой показатель 0,8 и
ниже, количество ретикулоцитов повышено, анизо-
цитоз и пойкилоцитоз эритроцитов, в стернальном
пунктате - умеренная гиперплазия эритроидного
ростка.
При гемолитической анемии
в отличие от
витамин В 12 -дефицитной - выраженная желтушность
кожи, значительная гепато- и спленомегалия. Лабо
раторно: анемия нормохромная, резко повышено ко
личество ретикулоцитов, число лейкоцитов повыше
но, гипербилирубинемия более 50 мкмоль/л за счет
непрямого билирубина, в моче - гемосидерин, в стер
нальном пунктате - выраженная гиперплазия эрит
роидного ростка.
Гипопластическая анемия
от витамин В 12 -
дефицитной отличается тяжестью общего состоя
ния, наличием геморрагического или гнойно-не-
Амбулаторная гематология
Кротического синдрома, отсутствием увеличения печени. Лабораторно: анемия нормохромная, резко снижены все показатели крови, гипербили-рубинемии нет, в стернальном пунктате - угнетение всех ростков кроветворения.
Ведениепациента
Цель лечения: достижение и поддержание устойчивой клинико-гематологической ремиссии. Задачи:
Перевод кроветворения с мегалобластическо-
го на нормобластический;
Пожизненное поддержание нормобластичес-
кого типа кроветворения перманентным вве
дением витамина В 12 и (или) фолиевой кис
лоты.
Организация лечения. Мегалобластные анемии лечатся амбулаторно. Однако в случаях, требующих трансфузионной терапии по жизненным показаниям, необходима госпитализация в терапевтическое или гематологическое отделение. Консультация гематолога целесообразна при первом выявлении заболевания, при наступлении ремиссии и далее 1 раз в год.
Плановая терапия
Информация для пациента и его семьи:
Краткие сведения о сущности заболевания.
Принципиально возможно создание устойчи
вой клинико-гематологической ремиссии при адек
ватной поддерживающей терапии.
Необходим контроль анализа крови 1 раз в
3 мес, введение витамина В 12 ежемесячно даже в
период стойкой ремиссии.
. Советы пациенту и его семье:
Питание, полноценное по белко во-витаминно
му составу.
При необходимости надо пройти курсовое ле
чение по поводу хронических заболеваний желудоч
но-кишечного тракта.
Медикаментозная терапия
В период первого выявления и обострения заболевания необходим домашний режим. Диета такая же, как и при железодефицитной анемии. Витамин В 12 по 500 мкг внутримышечно ежедневно в течение 7-10 дней, затем еще 7-10 инъекций через день. Улучшение наступает уже после первой или второй инъекции. На 3-7 день - ретикулоцитарный криз. Ремиссия индуцируется быстро, устойчивая. Фолиевая кислота назначается по 5-15 мг/сут. В период частичной ремиссии, когда пациент трудоспособен, но гематологическая норма еще не достигнута, нужно вводить
витамин В 12 по 500 мкг внутримышечно 1 раз в нед, 3 мес. В период полной ремиссии - пожизненное введение 500 мкг витамина В 12 1 раз в мес.
Примерная схема лечения беременных:
200 мкг 1 раз в 10 дней;
Фолиевая кислота 15 мг/сут с 1 -го по 30-й день
от начала лечения витамином В 12 ;
Гипотардиферон по 1 табл. в день с 30-го дня
в течение 1-2 мес.
Препараты железа необходимы, т.к. у беременных анемии, как правило, смешанного генеза.
Примерная схема лечения пожилых:
Витамин В 12 500 мкг внутримышечно ежед
невно 10 дней, затем через день 10 инъекций, затем
500 мкг 1 раз в неделю, 2-3 мес, затем 1 раз в 2 нед.
- 2 мес, далее 1 раз в мес. пожизненно;
Фолиевая кислота 10 мг/сут;
Поливитаминный препарат (ундевит) по 1 табл.
2 раза в день с 30 дня от начала лечения витамином
В 12 , в течение 1-2 мес, с перерывами на 2-3 мес.
Фитотерапия - см. раздел «Железодефицитные анемии».
Реабилитационная терапия
В период полной ремиссии 1 раз в месяц вводится 500 мкг витамина В 12 . При необходимости (при наличии признаков мегал областного кроветворения) весной и осенью вводится витамин В 12 по 200 мкг 1 раз в 10 дней. В 12 - и фолиеводефицитная анемия в период клинико-гематологической ремиссии не является противопоказанием к санаторно-курортному лечению, не влечет за собой ограничений в приеме физиопроцедур.
Критерии эффективности реабилитацион ной терапии:
Сохранение нормобластного кроветворения
(нормальные цифры эритроцитов, НЬ, цвето
вой показатель не выше 1,1; отсутствие мак-
роцитоза) при наличии только поддерживаю
щей терапии.
Отсутствие неврологических нарушений: из
вращения вкуса, онемение стоп и ладоней,
парестезии и др.
Медицинская экспертиза
Пациент временно нетрудоспособен до полного исчезновения признаков мегал области о го кроветворения и восстановления цифр красной крови до нормы.
Медико-социальная экспертиза, военно-врачебная экспертиза, предварительные и периодические медицинские осмотры - см. раздел «Хронические железодефицитные анемии».
Гемолитические анемии (шифры Д 58.9, Д 59)
Определение. Группа анемических состояний, при которых процесс разрушения эритроцитов преобладает над процессом их воспроизводства. При гемолитических анемиях эритроциты живут менее 100 дней.
Статистика. Патологическая пораженность невелика, составляет 0,6-2,8 случаев на 100000 населения. Врожденная гемолитическая анемия чаще встречается в Дагестане, приобретенная - в крупных центрах с развитой химической промышленностью.
Этиология, патогенез. Среди причинных факторов выделены:
Внутриэритроцитарные (эритроцитопатии,
ферментопатии, гемоглобинопатии).
Внеэритроцитарные:
Инфекционные;
Химические (лекарственные, профессио
нальные и бытовые интоксикации);
Физические (ожоги, наличие протезов сер
дечных клапанов);
Иммунологические (ауто- и гетероиммун-
ные формы);
Неизвестные (гемолиз при он ко патологии,
патологии печени и почек).
В патогенезе ведущую роль играет периферическое разрушение эритроцитов, появление в циркуля-торном русле продуктов распада и, как следствие, по данным анализа периферической крови, костномозговая регенеративная реакция и ее маркеры.
Клиника, диагностика. Гемолитический синдром состоит из трех симптомов: анемии, желтухи и спленомегалии. Диагностика часто затруднена, многим больным в течение долгих лет ставится диагноз хронического гепатита или цирроза печени, а анемия принимается за следствие этих заболеваний. Во
всех случаях желтухи с увеличением селезенки требуется тщательное обследование больных независимо от цифр гемоглобина, поскольку анемия может быть выражена слабо. Лабораторные показатели: анемия, чаще нормохромная, многократное увеличение числа ретикулоцитов, выраженная гипербилиру-бинемия за счет непрямого билирубина, гемосиде-рин в моче, в стернальном пунктате выраженная гиперплазия эритроидного ростка.
Классификация. Различают две большие группы гемолитических анемий: врожденные и приобретенные. Врожденные формы бывают чаще семейно-наследственными, наследуются по ауто сом но-доминантному и аутосомно-рецессивному типу.
Анемией называется клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в крови. Самые разнообразные патологические процессы могут служить основой развития анемических состояний, в связи с чем анемии следует рассматривать как один из симптомов основного заболевания. Распространенность анемий значительно варьирует в диапазоне от 0,7 до 6,9%. Причиной анемии может быть один из трех факторов или их сочетание: кровопотеря, недостаточное образование эритроцитов или усиленное их разрушение (гемолиз).Среди различных анемических состояний железодефицитные анемии являются самыми распространенными и составляют около 80% всех анемий.
Железодефицитная анемия - гипохромная микроцитарная анемия, развивающаяся вследствие абсолютного уменьшения запасов железа в организме. Железодефицитная анемия возникает, как правило, при хронической потере крови или недостаточном поступлении железа в организм.
По данным Всемирной организации здравоохранения, каждая 3-я женщина и каждый 6-й мужчина в мире (200 миллионов человек) страдают железодефицитной анемией.
Обмен железа
Железо является незаменимым биометаллом, играющим важную роль в функционировании клеток многих систем организма. Биологическое значение железа определяется его способностью обратимо окисляться и восстанавливаться. Это свойство обеспечивает участие железа в процессах тканевого дыхания. Железо составляет лишь 0,0065% массы тела. В организме мужчины с массой тела 70 кг содержится примерно 3,5 г (50 мг/кг массы тела) железа. Содержание железа в организме женщины с массой тела 60 кг составляет примерно 2,1 г (35 мг/кг массы тела). Соединения железа имеют различное строение, обладают характерной только для них функциональной активностью и играют важную биологическую роль. К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), ферменты негеминовой группы (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин. Железо входит в состав комплексных соединений и распределено в организме следующим образом:
- гемовое железо - 70%;
- депо железа - 18% (внутриклеточное накопление в форме ферритина и гемосидерина);
- функционирующее железо - 12% (миоглобин и содержащие железо энзимы);
- транспортируемое железо - 0,1% (железо, связанное с трансферрином).
Различают два вида железа: гемовое и негемовое. Гемовое железо входит в состав гемоглобина. Оно содержится лишь в небольшой части пищевого рациона (мясные продукты), хорошо всасывается (на 20-30%), на его всасывание практически не влияют другие компоненты пищи. Негемовое железо находится в свободной ионной форме - двухвалентного (Fe II) или трехвалентного железа (Fe III). Большая часть пищевого железа - негемовое (содержится преимущественно в овощах). Степень его усвоения ниже, чем гемового, и зависит от целого ряда факторов. Из продуктов питания усваивается только двухвалентное негемовое железо. Чтобы «превратить» трехвалентное железо в двухвалентное, необходим восстановитель, роль которого в большинстве случаев играет аскорбиновая кислота (витамин С). В процессе всасывания в клетках слизистой оболочки кишечника закисное железо Fe2+ превращается в окисное Fe3+ и связывается со специальным белком-носителем - трансферрином, который осуществляет транспорт железа к гемопоэтическим тканям и местам депонирования железа.
Накопление железа осуществляется белками ферритином и гемосидерином. При необходимости железо может активно освобождаться из ферритина и использоваться для эритропоэза. Гемосидерин является производным ферритина с более высоким содержанием железа. Из гемосидерина железо освобождается медленно. Начинающийся (прелатентный) дефицит железа можно определить по сниженной концентрации ферритина еще до исчерпания запасов железа, при еще сохраняющейся нормальной концентрации железа и трансферрина в сыворотке крови.
Что провоцирует Железодефицитная анемия:
Основной этиопатогенетический фактор развития железодефицитной анемии - дефицит железа. Наиболее частыми причинами возникновения железодефицитных состояний являются:
1. потери железа при хронических кровотечениях (наиболее частая причина, достигающая 80%):
-- кровотечения из желудочно-кишечного тракта: язвенная болезнь, эрозивный гастрит, варикозное расширение эзофагеальных вен, дивертикулы толстой кишки, инвазии анкилостомы, опухоли, НЯК, геморрой;
-- длительные и обильные менструации, эндометриоз, фибромиома;
-- макро- и микрогематурия: хронический гломеруло- и пиелонефрит, мочекаменная болезнь, поликистоз почек, опухоли почек и мочевого пузыря;
-- носовые, легочные кровотечения;
-- потери крови при гемодиализе;
-- неконтролируемое донорство;
2. недостаточное усваивание железа:
-- резекция тонкого кишечника;
-- хронический энтерит;
-- синдром мальабсорбции;
-- амилоидоз кишечника;
3. повышенная потребность в железе:
-- интенсивный рост;
-- беременность;
-- период кормления грудью;
-- занятия спортом;
4. недостаточное поступление железа с пищей:
-- новорожденные;
-- маленькие дети;
-- вегетарианство.
Патогенез (что происходит?) во время Железодефицитной анемии:
Патогенетически развитие железодефицитного состояния можно условно разделить на несколько стадий:
1. прелатентный дефицит железа (недостаточность накопления) - отмечается снижение уровня ферритина и снижение содержания железа в костном мозге, повышена абсорбция железа;
2. латентный дефицит железа (железодефицитный эритропоэз) - дополнительно снижается сывороточное железо, повышается концентрация трансферрина, снижается содержание сидеробластов в костном мозге;
3. выраженный дефицит железа = железодефицитная анемия - дополнительно снижается концентрация гемоглобина, эритроцитов и гематокрит.
Симптомы Железодефицитной анемии:
В период скрытого дефицита железа появляются многие субъективные жалобы и клинические признаки, характерные для железодефицитных анемий. Пациенты отмечают общую слабость, недомогание, снижение работоспособности. Уже в этот период могут наблюдаться извращение вкуса, сухость и пощипывание языка, нарушение глотания с ощущением инородного тела в горле, сердцебиение, одышка.
При объективном обследовании пациентов обнаруживаются «малые симптомы дефицита железа»: атрофия сосочков языка, хейлит, сухость кожи и волос, ломкость ногтей, жжение и зуд вульвы. Все эти признаки нарушения трофики эпителиальных тканей связаны с тканевой сидеропенией и гипоксией.
Больные железодефицитной анемией отмечают общую слабость, быструю утомляемость, затруднение в сосредоточении внимания, иногда сонливость. Появляются головная боль, головокружение. При тяжелой анемии возможны обмороки. Эти жалобы, как правило, зависят не от степени снижения гемоглобина, а от продолжительности заболевания и возраста больных.
Железодефицитная анемия характеризуется также изменениями кожи, ногтей и волос. Кожа обычно бледная, иногда с легким зеленоватым оттенком (хлороз) и с легко возникающим румянцем щек, она становится сухой, дряблой, шелушится, легко образуются трещины. Волосы теряют блеск, сереют, истончаются, легко ломаются, редеют и рано седеют. Специфичны изменения ногтей: они становятся тонкими, матовыми, уплощаются, легко расслаиваются и ломаются, появляется исчерченность. При выраженных изменениях ногти приобретают вогнутую, ложкообразную форму (койлонихия). У больных железодефицитной анемией возникает мышечная слабость, которая не наблюдается при других видах анемий. Ее относят к проявлениям тканевой сидеропении. Атрофические изменения возникают в слизистых оболочках пищеварительного канала, органов дыхания, половых органов. Поражение слизистой оболочки пищеварительного канала - типичный признак железодефицитных состояний.
Отмечается снижение аппетита. Возникает потребность в кислой, острой, соленой пище. В более тяжелых случаях наблюдаются извращения обоняния, вкуса (pica chlorotica): употребление в пищу мела, известки, сырых круп, погофагия (влечение к употреблению льда). Признаки тканевой сидеропении быстро исчезают после приема препаратов железа.
Диагностика Железодефицитной анемии:
Основные ориентиры в лабораторной диагностике железодефицитной анемии
следующие:
1. Среднее содержание гемоглобина в эритроците в пикограммах (норма 27-35 пг) снижено. Для его вычисления цветовой показатель умножают на 33,3. Например, при цветовом показателе 0,7 х 33,3 содержание гемоглобина равно 23,3 пг.
2. Средняя концентрация гемоглобина в эритроците снижена; в норме она составляет 31-36 г/дл.
3. Гипохромия эритроцитов определяется при микроскопии мазка периферической крови и характеризуется увеличением зоны центрального просветления в эритроците; в норме соотношение центрального просветления к периферическому затемнению равно 1:1; при железодефицитной анемии - 2+3:1.
4. Микроцитоз эритроцитов - уменьшение их размеров.
5. Разная по интенсивности окраска эритроцитов - анизохромия; наличие как гипо-, так и нормохромиых эритроцитов.
6. Разная форма эритроцитов - пойкилоцитоз.
7. Количество ретикулоцитов (при отсутствии кровопотери и периода ферротерапии) при железодефицитной анемии остается в норме.
8. Содержание лейкоцитов также в пределах нормы (за исключением случаев кровопотери или онкопатологии).
9. Содержание тромбоцитов чаще остается в пределах нормы; умеренный тромбоцитоз возможен при кровопотере в момент обследования, а содержание тромбоцитов уменьшается, когда в основе железодефицитной анемии лежит кровопотеря вследствие тромбоцитопении (например, при ДВС-синдроме, болезни Верльгофа).
10. Уменьшение количества сидероцитов вплоть до их исчезновения (сидероцит - это эритроцит, содержащий гранулы железа). С целью стандартизации изготовления мазков периферической крови рекомендуется использовать специальные автоматические устройства; образующийся при этом монослой клеток повышает качество их идентификации.
Биохимический анализ крови:
1. Снижение содержания железа в сыворотке крови (в норме у мужчин 13-30 мкмоль/л, у женщин 12-25 мкмоль/л).
2. ОЖСС повышена (отражает количество железа, которое может быть связано за счет свободного трансферрина; ОЖСС в норме - 30-86 мкмоль/л).
3. Исследование трансферриновых рецепторов иммуноферментным методом; их уровень повышен у больных железодефицитной анемией (у больных анемией хронических заболеваний - в норме или снижен, несмотря на аналогичные показатели обмена железа.
4. Латентная железосвязывающая способность сыворотки крови повышена (определяется путем вычитания из показателей ОЖСС показателя содержания сывороточного железа).
5. Процент насыщения трансферрина железом (отношение показателя железа сыворотки крови к ОЖСС; в норме 16-50%) снижен.
6. Уровень сывороточного ферритина тоже снижен (в норме 15-150 мкг/л).
Вместе с тем у больных железодефицитной анемией увеличено количество трансферриновых рецепторов и повышен уровень эритропоэтина в сыворотке крови (компенсаторные реакции кроветворения). Объем секреции эритропоэтина обратно пропорционален величине кислородтранспортной емкости крови и прямо пропорционален кислородному запросу крови. Следует учитывать, что уровень сывороточного железа выше в утренние часы; перед началом и во время менструации он выше, чем после менструации. Содержание железа в сыворотке крови в первые недели беременности выше, чем в последнем ее триместре. Уровень сывороточного железа повышается на 2-4-й день после лечения железосодержащими препаратами, а затем снижается. Значительное потребление мясных продуктов накануне исследования сопровождается гиперсидеремией. Эти данные необходимо учитывать при оценке результатов исследования сывороточного железа. Не менее важно соблюдать технику лабораторного исследования, правила забора крови. Так, пробирки, в которые собирают кровь, предварительно должны быть промыты соляной кислотой и бидистиллированной водой.
Исследование миелограммы выявляет умеренную нормобластическую реакцию и резкое снижение содержания сидеробластов (эритрокариоцитов, содержащих гранулы железа).
О запасах железа в организме судят по результатам десфералевой пробы. У здорового человека после внутривенного введения 500 мг десфераля выводится с мочой от 0,8 до 1,2 мг железа, в то время как у больного с железодефицитной анемией выведение железа снижается до 0,2 мг. Новый отечественный препарат дефериколиксам идентичен десфералю, но дольше циркулирует в крови и поэтому точнее отражает уровень запасов железа в организме.
С учетом уровня гемоглобина железодефицитная анемия, как и другие формы анемий, подразделяются на анемию тяжелой, средней и легкой степени. При железодефицитной анемии легкой степени концентрация гемоглобина ниже нормы, но более 90 г/л; при железодефицитной анемии средней степени содержание гемоглобина менее 90 г/л, но более 70 г/л; при тяжелой степени железодефицитной анемии концентрация гемоглобина менее 70 г/л. Вместе с тем клинические признаки тяжести анемии (симптомы гипоксического характера) не всегда соответствуют степени тяжести анемии по лабораторным критериям. Поэтому предложена классификация анемий по степени выраженности клинических симптомов.
По клиническим проявлениям выделяют 5 степеней тяжести анемий:
1. анемия без клинических проявлений;
2. анемический синдром умеренной выраженности;
3. выраженный анемический синдром;
4. анемическая прекома;
5. анемическая кома.
Умеренная степень тяжести анемии характеризуется общей слабостью, специфическими признаками (например, сидеропеническими или признаками дефицита витамина В12); при выраженной степени тяжести анемии появляются сердцебиение, одышка, головокружение и др. Прекоматозное и коматозное состояния могут развиться в считанные часы, что особенно характерно для мегалобластной анемии.
Современные клинические исследования показывают, что среди больных железодефицитной анемией наблюдается лабораторная и клиническая гетерогенность. Так, у части больных с признаками железодефицитной анемии и сопутствующими воспалительными и инфекционными заболеваниями уровень сывороточного и эритроцитарного ферритина не снижается, однако после ликвидации обострения основного заболевания их содержание падает, что свидетельствует об активации макрофагов в процессах расходования железа. У части больных уровень эритроцитарного ферритина даже повышается, особенно у больных с длительным течением железодефицитной анемии, что приводит к неэффективному эритропоэзу. Иногда наблюдаются повышение уровня сывороточного железа и эритроцитарного ферритина, снижение трансферрина сыворотки крови. Предполагается, что в этих случаях нарушен процесс передачи железа в гемсинтезирующие клетки. В некоторых случаях определяется одновременно дефицит железа, витамина В12 и фолиевой кислоты.
Таким образом, даже уровень сывороточного железа не всегда отражает степень дефицита железа в организме при наличии других признаков железодефицитной анемии. Только уровень ОЖСС при железодефицитной анемии всегда повышен. Поэтому, ни один биохимический показатель, в т.ч. ОЖСС, нельзя рассматривать как абсолютный диагностический критерий при железодефицитной анемии. В то же время морфологическая характеристика эритроцитов периферической крови и компьютерный анализ основных параметров эритроцитов являются решающими в скрининговой диагностике железодефицитной анемии.
Диагностика железодефицитных состояний затруднена в случаях, когда содержание гемоглобина остается в норме. Железодефицитная анемия развивается при наличии тех же факторов риска, что и при железодефицитной анемии, а также у лиц с повышенной физиологической потребностью в железе, прежде всего у недоношенных детей в раннем возрасте, у подростков с быстрым увеличением роста и массы тела, у доноров крови, при алиментарной дистрофии. На первой стадии дефицита железа клинические проявления отсутствуют, а дефицит железа определяют по содержанию гемосидерина в макрофагах костного мозга и по абсорбции радиоактивного железа в ЖКТ. На второй стадии (латентный дефицит железа) наблюдается увеличение концентрации протопорфирина в эритроцитах, уменьшается количество сидеробластов, появляются морфологические признаки (микроцитоз, гипохромия эритроцитов), уменьшается среднее содержание и концентрация гемоглобина в эритроцитах, снижаются уровень сывороточного и эритроцитарного ферритина, насыщение трансферрина железом. Уровень гемоглобина в этой стадии остается достаточно высоким, а клинические признаки характеризуются снижением толерантности к физической нагрузке. Третья стадия проявляется явными клиническими и лабораторными признаками анемии.
Обследование больных с железодефицитной анемией
Для исключения анемий, имеющих общие черты с железодефицитной анемией, и выявления причины дефицита железа необходимо полное клиническое обследование больного:
Общий анализ крови с обязательным определением количества тромбоцитов, ретикулоцитов, изучением морфологии эритроцитов.
Биохимический анализ крови: определение уровня железа, ОЖСС, ферритина, билирубина (связанного и свободного), гемоглобина.
Во всех случаях необходимо исследовать пунктат костного мозга до назначения витамина В12 (прежде всего, для дифференциальной диагностики с мегалобластной анемией).
Для выявления причины железодефицитной анемии у женщин обязательна предварительная консультация гинеколога с целью исключения заболеваний матки и ее придатков, а у мужчин - осмотр проктолога для исключения кровоточащего геморроя и уролога для исключения патологии предстательной железы.
Известны случаи экстрагенитального эндометриоза, например в дыхательных путях. В этих случаях наблюдается кровохарканье; фибробронхоскопия с гистологическим исследованием биоптата слизистой оболочки бронха позволяет установить диагноз.
В план обследования входят также рентгенологическое и эндоскопическое исследование желудка и кишечника с целью исключения язв, опухолей, в т.ч. гломических, а также полипов, дивертикула, болезни Крона, язвенного колита и т.д. При подозрении на легочный сидероз проводят рентгенографию и томографию легких, исследование мокроты на альвеолярные макрофаги, содержащие гемосидерин; в редких случаях необходимо гистологическое исследование биоптата легких. При подозрении на патологию почек необходимы общий анализ мочи, исследование сыворотки крови на мочевину и креатинин, по показаниям - ультразвуковое и рентгенологическое исследование почек. В ряде случаев приходится исключать эндокринную патологию: микседему, при которой дефицит железа может развиться вторично вследствие поражения тонкой кишки; ревматическую полимиалгию - редкое заболевание соединительной ткани у пожилых женщин (реже - у мужчин), характеризуется болью в мышцах плечевого или тазового пояса без каких-либо объективных изменений в них, а в анализе крови - анемия и увеличение СОЭ.
Дифференциальная диагностика железодефицитных анемий
При постановке диагноза железодефицитной анемии необходимо проводить дифференциальный диагноз с другими гипохромными анемиями.
Железоперераспределительные анемии - достаточно частая патология и по частоте развития занимает второе место среди всех анемий (после железодефицитной анемии). Она развивается при острых и хронических инфекционно-воспалительных заболеваниях, сепсисе, туберкулезе, ревматоидном артрите, болезнях печени, онкологических заболеваниях, ИБС и др. Механизм развития гипохромной анемии при этих состояниях связан с перераспределением железа в организме (оно находится преимущественно в депо) и нарушением механизма реутилизации железа из депо. При вышеперечисленных заболеваниях происходит активация макрофагальной системы, когда макрофаги в условиях активации прочно удерживают железо, тем самым нарушая процесс его реутилизации. В общем анализе крови отмечается умеренное снижение гемоглобина (<80 г/л).
Основным отличием от железодефицитной анемии являются:
- повышенный уровень ферритина сыворотки, что свидетельствует о повышенном содержании железа в депо;
- уровень сывороточного железа может сохраняться в пределах нормальных значений или быть умеренно сниженным;
- ОЖСС остается в пределах нормальных значений либо снижается, что говорит об отсутствии Fe-голодания сыворотки.
Железонасыщенные анемии развиваются в результате нарушения синтеза гема, которое обусловлено наследственностью либо может быть приобретенным. Гем образуется из протопорфирина и железа в эритрокариоцитах. При железонасыщенных анемиях происходит нарушение активности ферментов, участвующих в синтезе протопорфирина. Следствием этого является нарушение синтеза гема. Железо, которое не было использовано для синтеза гема, депонируется в виде ферритина в макрофагах костного мозга, а также в виде гемосидерина в коже, печени, поджелудочной железе, миокарде, в результате чего развивается вторичный гемосидероз. В общем анализе крови будет регистрироваться анемия, эритропения, снижение цветового показателя.
Для показателей обмена железа в организме характерно повышение концентрации ферритина и уровня сывороточного железа, нормальные показатели ОЖСС, повышение насыщения трансферрина железом (в некоторых случаях достигает 100 %). Таким образом, основными биохимическими показателями, позволяющими оценить состояние обмена железа в организме, являются ферритин, железо сыворотки, ОЖСС и % насыщения трансферрина железом.
Использование показателей обмена железа в организме дает возможность врачу-клиницисту:
- выявить наличие и характер нарушений обмена железа в организме;
- выявить наличие дефицита железа в организме на доклинической стадии;
- проводить дифференциальную диагностику гипохромных анемий;
- оценить эффективность проводимой терапии.
Лечение Железодефицитной анемии:
Во всех случаях железодефицитной анемии необходимо установить непосредственную причину возникновения данного состояния и по возможности ликвидировать ее (чаще всего устранить источник кровопотери или провести терапию основного заболевания, осложнившегося сидеропенией).
Лечение железодефицитной анемии должно быть патогенетически обоснованным, комплексным и нацеленным не только на ликвидацию анемии как симптома, но и на ликвидацию дефицита железа и восполнение его запасов в организме.
Программа лечения железодефицитной анемии:
- устранение причины железодефицитной анемии;
- лечебное питание;
- ферротерапия;
- профилактика рецидивов.
Больным железодефицитными анемиями рекомендуется разнообразная диета, включающая мясные продукты (телятина, печень) и продукты растительного происхождения (бобы, сою, петрушку, горох, шпинат, сушеные абрикосы, чернослив, гранаты, изюм, рис, гречневую крупу, хлеб). Однако невозможно добиться противоанемического эффекта только диетой. Если даже больной будет питаться высококалорийными продуктами, содержащими животный белок, соли железа, витамины, микроэлементы,- можно достичь всасывания железа не более 3-5 мг в сутки. Необходимо применение препаратов железа. В настоящее время в распоряжении врача имеется большой арсенал лекарственных препаратов железа, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, различных лекарственных форм.
Согласно рекомендациям, разработанным ВОЗ, при назначении препаратов железа предпочтение отдают препаратам, содержащим двухвалентное железо. Суточная доза должна достигать у взрослых 2 мг/кг элементарного железа. Общая длительность лечения не менее трех месяцев (иногда до 4-6 месяцев). Идеальный железосодержащий препарат должен обладать минимальным количеством побочных эффектов, иметь простую схему применения, наилучшее соотношение эффективность/цена, оптимальное содержание железа, желательно наличие факторов, усиливающих всасывание и стимулирующих гемопоэз.
Показания к парентеральному введению препаратов железа возникают при непереносимости всех пероральных препаратов, нарушении всасывания (неспецифический язвенный колит, энтерит), язвенной болезни желудка и двенадцатиперстной кишки в период обострения, при тяжелой анемии и жизненной необходимости быстрого восполнения дефицита железа. Об эффективности препаратов железа судят по изменениям лабораторных показателей в динамике. К 5-7 дню лечения увеличивается количество ретикулоцитов в 1,5-2 раза по сравнению с исходными данными. Начиная с 10-го дня терапии повышается содержание гемоглобина.
Учитывая прооксидантное и лизосомотропное действие препаратов железа, их парентарельное введение можно сочетать с внутривенным капельным введением реополиглюкина (400 мл - один раз в неделю), который позволяет защитить клетку и избежать перегрузки макрофагов железом. Учитывая значительные изменения функционального состояния мембраны эритроцита, активацию перекисного окисления липидов и снижение антиоксидантной защиты эритроцитов при железодефицитной анемии, необходимо в схему лечения вводить антиоксиданты, мембраностабилизаторы, цитопротекторы, антигипоксанты, такие как a-токоферол до 100-150 мг в сутки (либо аскорутин, витамин А, витамин С, липостабил, метионин, милдронат и др.), а также сочетать с витаминами В1, В2, В6, В15, липоевой кислотой. В некоторых случаях целесообразно применение церулоплазмина.
Список препаратов, которые применяют при лечении железодефицитной анемии: