Лапароскопическая пластика лоханочно-мочеточникового сегмента (ЛМС). Гидронефроз слева. Открытая пластика ЛМС слева Новый способ операции при гидронефрозе у детей
Все материалы на сайте подготовлены специалистами в области хирургии, анатомии и профильных дисциплинах.
Все рекомендации носят ориентировочный характер и без консультации лечащего врача неприменимы.
Гидронефроз – это заболевание, связанное с расширением почечных чашек или лоханки (места, куда сливается и где накапливается моча). Оно встречается чаще всего в детском возрасте. Причем поражается обычно только правая или левая почка, гораздо реже – сразу обе. При отсутствии лечения гидронефроз вызывает разрушение ткани органа и ухудшение его функций. Пациент может испытывать сложности с мочеиспусканием, ощущать боли, сопровождающиеся повышением температуры. В моче иногда присутствует кровь.
Лечение главным образом хирургическое. Консервативная терапия играет только вспомогательную роль – борьба с воспалением, болью. Плановая операция при гидронефрозе в большинстве случаев позволяет сохранить орган и восстановить его функции, вмешательство по поводу удаления почки проводится только в крайнем случае.
Показания к хирургическому вмешательству
Оперативное лечение гидронефроза может быть рекомендовано, когда его потенциальная польза превышает риски от операции. Его назначают при:
- Нарушении оттока мочи;
- Хронической почечной недостаточности;
- Частых воспалительных процессах в почке, спровоцированных расширением лоханки;
- Периодических болях;
- Нарушении функций органа;
- Почечной недостаточности.

Подготовка к операции
Главной процедурой перед хирургическим вмешательством является дренирование почки. Оно выполняется в следующих случаях:
- Почечная недостаточность.
- Пиелонефрит – воспаление почки.
- Сильный болевой симптом и/или тяжелое состояние больного.
- Гидронефроз почки в терминальной стадии.
В некоторых случаях операция может быть затруднительна, например, при азотемии – наличии в крови повышенного количества азотистых оснований из-за нарушения работы почек. В таком случае пациенту показаны ванны, диета и прием соответствующих лекарственных препаратов.
К другим подготовительным процедурам можно отнести:
- Гемодиализ (внешнее очищение крови);
- Перитонеальный диализ (очищение крови внутри организма).
Разновидности оперативного вмешательства
Существует три основных группы органосохраняющих операций, которые проводят при гидронефрозе:
- Открытые. Они связаны с рассечением тканей скальпелем. Действия хирурга производятся под контролем зрения.
- Лапароскопические. Все инструменты вводятся через небольшие проколы (порты) в коже. Врач видит изображение на экране за счет использования специального инструмента с видеокамерой.
- Эндоурологические. Рассечения тканей не происходит. Эндоскоп вводится в уретру. Визуализация происходит при помощи аппарата УЗИ или рентгена.
Важно! При грубых нарушениях в работе почки, а также разрушении ее паренхимы может быть показана нефрэктомия (удаление всего органа или его части).
Иногда врач принимает такое решение в ходе операции, когда ему становятся доступны новые данные о состоянии почки. Нефрэктомия может быть проведена как открытым, так и лапароскопическим способом.
Открытая операция
Все виды данного вмешательства проводятся под общим наркозом. Доступ, как правило, подреберный, то есть больному предстоит лежать на спине или боку. Наиболее распространенный вид вмешательства – операция по Андерсону-Хайнсу. Она применяется при стриктуре лоханочно-мочеточникового сегмента (сужении участка, где происходит попадание мочи из почки в мочеточник, и, как следствие, нарушении ее нормального оттока).
Врач обнажает нижней сегмент почки, удаляет суженый участок. Расширенная лоханка также усекается. Здоровые концы сшиваются (формируется анастомоз). Доктор проверяет его герметичность – отсутствие подтеканий мочи.

Трудности могут возникнуть при внутрипочечно расположенной лоханке. В этом случае после резекции (удаления поврежденных участков) здоровый конец мочеточника вводится и вшивается непосредственно в орган. Возможно применение сосудопластики, если причиной гидронефроза стал дополнительный сосудистый пучок, который снабжает нижний сегмент почки.
В ране остается катетер, который позволяет контролировать процесс образования мочи. Его удаляют на вторые сутки. В сам мочеточник может быть вставлена трубка для предотвращения его повторного сужения. Ее удаляют через несколько недель.
Эндоскопические методы
Они начали входить в применение, начиная с середины прошлого века. Эффективность некоторых их разновидностей достигает 80%. Выделяют следующие способы проведения вмешательства:
- Бужирование. Метод предполагает последовательное введение в мочеточник через уретру бужей (стержней) с увеличением диаметром. Таким образом достигается постепенное расширение канала.
- Баллонная дилатация. Баллон с метками вводят в уретру. Контроль над процедурой проводят при помощи рентгеноконтрастного метода. Участок со стриктурой “расширяют” под давлением. Контрастное вещество из баллона наполняет мочеточник.
- Эндотомия. Этот метод признан наиболее действенным. Спайки и пораженные участки удаляются за счет лазерного излучения, действия электрического тока или холодного ножа.
Все эндоскопические операции завершаются интубацией. В мочеточник вставляется трубка, которая находится в нем до полутора месяцев. По истечении этого срока ее удаляют при помощи эндоскопа через уретру.
Лапароскопия
 Операция проводится, как правило, под общим наркозом.
Положение пациента – лежа на боку. Больного могут фиксировать эластичными бинтами, придавать правильный наклон с помощью валиков. По ходу операции положение может меняться.
Операция проводится, как правило, под общим наркозом.
Положение пациента – лежа на боку. Больного могут фиксировать эластичными бинтами, придавать правильный наклон с помощью валиков. По ходу операции положение может меняться.
С брюшной стороны тела пациента врач делает 4-5 проколов диаметром, как правило, до 10 мм. Иногда их производят со стороны копчика. В первый – самый крупный, вводится эндоскоп, соединенный с видеокамерой. Остальные порты предназначены для хирургических инструментов.
Через первый прокол в полость тела нагнетается до 2 литров газа. Обычно это оксид углерода, который не впитывается тканями в отличие от кислорода. Он служит для лучшей визуализации и создания пространства для действий хирурга.
При помощи манипуляторов врач выделяет почку и мочеточник. Далее он отсекает все пораженные участки. Здоровый конец мочеточника соединяется с лоханкой. После этого троакары (инструменты для выполнения эндоскопических процедур) извлекаются. В наложении швов обычно нет необходимости. На место проколов помещается асептическая повязка.
Нефрэктомия
Операция по удалению органа проводится только в крайнем случае и только при одностороннем гидронефрозе (поражение только левой или правой почки). Показаниями к нефрэктомии является сильная атрофия ткани органа, практически полное нарушение его функций, последняя стадия заболевания. Сохранение почки опасно, поскольку она может стать местом скопления инфекционных агентов.
Удаление органа производят под общим наркозом. Операция может быть проведена открытым способом или лапароскопически. Почка отделяется от прилегающих тканей и органов тупым методом. Крупные кровеносные сосуды и мочеточник перевязываются или клипируются (их просвет закрывается при помощи клипс), мелкие – коагулируются, запаиваются при помощи слабых разрядов электрического тока. Почечная ножка ушивается, после чего извлекается сам орган. На рану накладывают швы и при открытой, и при лапароскопической операции, поскольку требуются проколы большого диаметра (иногда до 20 мм) для прохождения через них удаленной почки.
Особенности оперирования в детском возрасте
 Перед хирургическим вмешательством ребенку необходимо пройти все необходимые исследования для диагностики и выявления показаний к операции. Детям младшего возраста в уретру на весь подготовительный период вставляется катетер. Операция может быть проведена новорожденным, они ее переносят обычно хорошо. Показаниями может служить нарушения оттока мочи, выявленные в ходе беременности
или мед. персоналом роддома, или результаты УЗИ, проводимого в 1 месяц.
Перед хирургическим вмешательством ребенку необходимо пройти все необходимые исследования для диагностики и выявления показаний к операции. Детям младшего возраста в уретру на весь подготовительный период вставляется катетер. Операция может быть проведена новорожденным, они ее переносят обычно хорошо. Показаниями может служить нарушения оттока мочи, выявленные в ходе беременности
или мед. персоналом роддома, или результаты УЗИ, проводимого в 1 месяц.
Нефрэктомию из-за высокой способности ткани к регенерации проводить нецелесообразно. От нее отказываются, если хотя бы 10% функций органа сохранено. Чаще всего используется открытая операция, проводимая по методу Андерсона-Хайнса. Применяется, главным образом общий наркоз.
Операция для детей может быть моральна тяжела, но они быстро забывают все неприятности. Малоинвазивные методы также могут быть использованы в детском возрасте – чем старше ребенок, тем больше для них показаний. Опасность лапароскопии заключается в повреждении соседних органов, поскольку хирург видит клиническую картину только на экране монитора. В раннем возрасте непосредственная визуализация зрением крайне важна.
У детей выше риск послеоперационных осложнений, чем у взрослых. Но в последние годы, благодаря тщательной диагностике, антибактериальной терапии и послеоперационному ведению его удалось снизить с 30% до 4-8%.
Восстановительный период
В первые 7-10 дней после хирургического вмешательства пациент получает лекарственные препараты – противовоспалительные, антибиотические, восстанавливающие. Необходимо ограничить физическую активность.

После операции важно снизить нагрузку на почки для полного восстановления их функций. Для этого необходимо в первую очередь диета:
- Отказ от жирной, острой и сильносоленой пищи;
- Повышенное количество свежих овощей и фруктов в ежедневном рационе;
- Лимит потребления жидкости – 2 литра в день.
Соблюдать подобные ограничения желательно как можно дольше – до 3 лет.
Послеоперационные осложнения
Наиболее опасными последствиями являются следующие:
- Рецидив. При открытых операциях последующее сужение мочеточника наблюдается в 10-18% случаев, при других видах вмешательства – несколько реже. Оно требует повторного проведения процедуры.
- Подтекание мочи из раны. Оно может прекратиться самопроизвольно или потребовать наложения дополнительного шва на анастомоз.
- Воспаление почечной лоханки. Для предотвращения инфицирования больной получает антибиотики.
- Вторичное сдавление мочеточника паренхимой (рыхлой тканью) почки и нарушение оттока мочи. Такое осложнение может потребовать установку стента (трубки). Его удаление производят через несколько недель.
Цена операции
 Провести пластику лоханки и мочеточника во взрослом возрасте можно по квоте.
Комиссия врачей принимает решения о предоставлении пациенту права на получение высокотехнологичной помощи (как правило, срок рассмотрения заявки – 7 дней). До 18 лет операция проводится по направлению из поликлиники/роддома.
Нефрэктомия по показаниям осуществляется бесплатно в любом возрасте.
Провести пластику лоханки и мочеточника во взрослом возрасте можно по квоте.
Комиссия врачей принимает решения о предоставлении пациенту права на получение высокотехнологичной помощи (как правило, срок рассмотрения заявки – 7 дней). До 18 лет операция проводится по направлению из поликлиники/роддома.
Нефрэктомия по показаниям осуществляется бесплатно в любом возрасте.
Провести операцию платно является решением пациента. Иногда может быть сложно получить направление на лапароскопическое вмешательство, или в больнице по месту жительства пациента отсутствует подобное оборудование. Стоимость отрытой операции – около 70 000 рублей. Лапароскопия обойдется в 50 000 – 100 000 рублей. Эндоурологические виды вмешательства в частных клиниках обычно не проводятся. Удаление почки без учета пребывания в стационаре и диагностических исследований будет стоить от 15 000 – 30 000 рублей.
Пластика мочеточника - метод хирургического лечения, который используется для полного восстановления функции и проводимости мочевыводящих путей.
В клинической практике используется несколько вариантов выполнения этой операции с учетом локализации заболеваний или патологического процесса, степени повреждения мочеточника и индивидуальных особенностей организма пациента.
На данный момент в клинической практике используются несколько способов проведения операции на мочеточнике:
- выкраивание лоскута из тканей мочевого пузыря;
- использование тканей кишечника для замены поврежденного участка.
Операция проводится под эндотрахеальным наркозом. На предварительно подготовленном операционном поле хирург иссекает участок кишки или стенки мочевого пузыря, сохраняя на нем сосуды, ответственные за кровоснабжение.
Полученный лоскут обрабатывается дезинфицирующими веществами, после чего в него вводится трубка. После удаления поврежденного мочеточника новый сформированный орган располагают на его месте.
В некоторых случаях трансплантат может вшиваться в мочевой пузырь, который будет подвержен резекции в этом участке.
Показания

При отсутствии желаемого терапевтического эффекта от консервативной терапии и невозможности восстановить функционирование мочеточника назначается проведение пластической операции. Основными показаниями к ней являются:
- гидронефроз (расширение почечной лоханки и чашек);
- гидроуретеронефроз, развившийся на фоне образования стриктур (один из видов органических повреждений мочеточника);
- ранее перенесенные повреждения почки или мочеточника, связанные с травмами или гинекологическими оперативными вмешательствами;
- обструкции мочевых путей, обусловленные различными патологиями и послеродовыми осложнениями (нарушения, препятствующие оттоку мочи).
Противопоказания

К основным противопоказаниям для проведения любого оперативного вмешательства относятся следующие факторы:
- беременность;
- наличие сахарного диабета;
- тяжелые заболевания сердечно-сосудистой системы;
- нарушение в работе коагуляционной системы крови;
- инфекционные заболевания.
У пациента также могут быть выявлены индивидуальные противопоказания, поэтому важно пройти полное обследование и должным образом подготовиться к проведению операции.
Подготовка к оперативному вмешательству

Перед проведением пластики мочеточника врач должен провести тщательное обследование и оценку состояния здоровья пациента. Важно своевременное выявление инфекций мочеполовой системы.
При их обнаружении проводится курс антибактериальной терапии, и лишь после этого выполнение оперативного вмешательства. Также пациент обязан сдать анализы для оценки показателей свертываемости крови и т. д.
Проведение аллергопроб важно для выявления возможных аллергических реакций на препараты и материалы, используемые в ходе оперативного вмешательства. Еще одним важным этапом является бактериологическое исследование.
После тщательного сбора анамнеза жизни, заболевания, оценки полученных данных анализов врач сможет назначить дату операции.
Виды операций на мочеточнике

Хирургическое вмешательство может проводиться под эндотрахеальным общим наркозом.
После введения определенной дозы анестезирующего препарата пациенту устанавливается катетер, который способствует выведению мочи во время операции и периода реабилитации. Операции осуществляется посредством:
- Кишечной пластики лоханочно-мочеточникового сегмента: сегментарная замена мочеточника с помощью трансплантата из мочевого пузыря или кишечника.
- Уретероуретероанастомоза: происходит удаление поврежденного сегмента и дальнейшее сшивание мочевыводящих путей.
- Кишечная пластика
Полная или же частичная замена мочеточника подразумевает замену органа с помощью трансплантата, сформированного из тканей кишечника.
Лоскут кишки образует стенки мочеточника, внутри находится временный катетер, после этого он сшивается с почечной чашкой для создания нового мочеточника.
При наличии функционирующего участка органа выполняется сегментарная пластика: сшивание трансплантата со здоровым участком и вывод катетера наружу.
Он будет выполнять функцию мочеточника до полного восстановления сегмента. Частичная пластика может применяться при необходимости удаления опухоли или большого участка пораженного органа.
- Операция по Боари
Для проведения этого вида хирургического лечения характерно формирование будущей трубки мочеточника из стенки мочевого пузыря.
Из его тканей иссекается небольшой участок, размер которого будет больше пораженной области (для предотвращения сжатия мочеточника). Такая операция используется при парном поражении мочеточников.
- Эндопластика устья мочеточника
Этот вид пластики может применяться при выявлении у пациента пузырно-мочеточникового рефлюкса. При проведении этой операции риск развития послеоперационных патологий и осложнений минимален.
Пластика проводится с использованием объемообразующего геля, который вводится посредством иглы под слизистую. Благодаря этому происходит расширение мочеточника. Затем в его полость вводится катетер на последующие 12 часов послеоперационного периода.
- Уретероуретероанастомоз
Этот вид оперативного вмешательства применяется при диагностировании злокачественных новообразований, затрагивающих мочеточник, пузырно-мочеточникового рефлюкса и пиелонефрита.
Его суть состоит в соединении участков мочевыводящего канальца с помощью анастомоза: две части мочеточника соединяются в одну протоку. Все пораженные участки замещаются имплантатами.
Реабилитационный период

После завершения операции все пациенты переводятся в отделение реанимации и интенсивной терапии до полной стабилизации их состояния. В первые несколько дней больной должен находиться под постоянным контролем специалистов.
Контроль состояния пациента и его витальных функций в стационаре осуществляется посредством специальных датчиков и сбора данных о количестве выделяемой мочи. Спустя несколько дней удаляются катетеры.
Длительность нахождения больного в стационаре зависит от его состояния, сложности проведенного вмешательства, состояния прооперированных органов.
При использовании лапароскопического доступа пациент находится в клинике не более 3-4 дней, а при выполнении полостной операции этот срок может увеличиваться до 2-3 недель.
Важно! После пластики необходимо четко придерживаться всех рекомендаций врача.
На протяжении следующих 2-3 месяцев после проведения операции врачи советуют ограничить некоторые виды физических нагрузок: пациенту запрещается поднимать тяжести и заниматься тяжелым физическим трудом.
Также обязательным условием является систематическое посещение специалиста для планового осмотра. Это необходимо для динамического наблюдения за состоянием трансплантата и работой мочевыделительной системы.
По результатам полученных данных врач может корректировать план медикаментозной терапии или режим.
Возможные осложнения

Осложнения при проведении лапароскопической пластики мочеточника могут возникать как во время хирургического вмешательства, так и после его завершения. Их можно разделить на несколько групп:
- последствия, связанные с анестезией: нарушения кровообращения, остановка дыхания при извлечении трубки для интубации, попадание содержимого желудка в дыхательные пути, пневмония и т. д.;
- осложнения, связанные с особенностями лапароскопического доступа: возможность повреждения тканей внутренних органов во время установки троакаров, нарушение кровообращения из-за нагнетания углекислого газа во внутренние полости организма пациента и т. д.;
- осложнения, связанные с самой операцией: кровотечения во время проведение хирургического вмешательства или после, инфекция послеоперационной раны или мочевыделительной системы, в редких случаях возможно повреждение почки.
В раннем послеоперационном периоде может наблюдаться несостоятельность швов, приводящая к утечке мочи и необходимости проведения повторного оперативного вмешательства.
На поздних этапах возможен рецидив гидронефроза из-за сужения пересаженного сегмента в месте проведения пластики.
Также у некоторых пациентов может возникнуть необходимость проведения операции с открытым доступом во время проведения лапароскопии из-за технических сложностей во время выполнения пластики мочеточника.
При полостной операции осложнением также может стать развитие грыжи.
В заключение
При успешном проведении операции и приживлении мочевыводящего канала прогноз результатов лечения и дальнейшего здоровья пациента благоприятен. Во время реабилитации пациенту показан строгий постельный режим на срок не менее 2 недель.
Благодаря индивидуальному подбору медикаментозной терапии обеспечивается профилактика отторжения пересаженного органа и бактериального воспаления.
Полный реабилитационный период после хирургического вмешательства длится около 2-3 месяцев. В этот период пациент должен придерживаться диеты, назначенной врачом, и крайне аккуратно дозировать физические нагрузки.
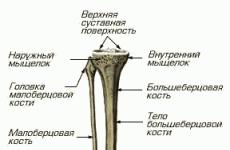
Лоханочно-мочеточниковый сегмент представляет собой область, где лоханка почки, в которой собирается моча, соединяется с мочеточником. Гидронефроз возникает на фоне переполнения почки мочой.
К причинам развития такой патологии относят как врожденные, так и приобретенные факторы. К врожденным факторам, провоцирующим гидронефроз, относят наличие дополнительного сосуда, передавливающего лоханочно-мочеточниковый сегмент, а также сужение выхода из почки. Зачастую именно при таких состояниях патология развивается бессимптомно и длительное время не подвергается лечению. К основным причинам приобретенного заболевания относят травмы мочеточника и отсутствие своевременно проведенной адекватной терапии камней в почках.
Когда показана лапароскопическая пластика при гидронефрозе?
Вмешательства проводятся при препятствиях в лоханочно-мочеточниковом сегменте, которые приводят к застою мочи. Пластика позволяет быстро и эффективно восстановить проходимость и обеспечить адекватный и своевременный сброс мочи.
Важно! Пластика при гидронефрозе – единственный способ восстановить нормальную анатомию внутренних органов. Патология не может быть устранена лекарственными препаратами и другими консервативными методами терапии. Откладывать вмешательство нельзя! Это может привести к усугублению ситуации и ухудшению состояния пациента.
Противопоказания к лапароскопической пластике ЛМС
Вмешательство не проводится при:
- Сниженных показателях свертываемости крови
- Беременности на поздних сроках
- Острой глаукоме
- Инфекционных заболеваниях
Решение о выполнении операции всегда принимает врач. Для этого он проводит тщательный осмотр пациента и назначает необходимые обследования.
Как подготовиться к операции?
Пластика ЛМС – вмешательство, которое проводится только после:
- Консультации с терапевтом, урологом и анестезиологом . При наличии хронических заболеваний пациент также посещает ряд узких специалистов. Это позволяет устранить риски осложнений и выявить все противопоказания. Врачи обязательно выдают необходимые рекомендации. Придерживаясь их, пациент повышает шансы на положительный исход вмешательства и быструю реабилитацию после него
- Полного обследования . Обычно оно включает сдачу анализов мочи и крови, прохождение исследований работы сердца и легких. Возможно проведение и других обследований. Все направления выдает врач
- Тщательной подготовки кишечника и приема антимикробных препаратов , позволяющих предотвратить инфекционные осложнения после вмешательства
Важно! Если пациент страдает от аллергических реакций на определенные препараты или индивидуальной непереносимости, он должен сообщить об этом специалисту. Так можно предотвратить возможные осложнения в ходе вмешательства и после его окончания.
Как проводится вмешательство?
Пластика почки и мочеточника при гидронефрозе проводится под общим наркозом или спинномозговой анестезией. Доступ к внутренним органам обеспечивается благодаря выполнению нескольких проколов диаметром от 0,5 до 1 см. Надрезы располагаются на передней брюшной стенке.
В ходе вмешательства пациента укладывают на бок. После его брюшная полость заполняется углекислым газом. Затем вводится лапароскоп (специальная камера) и все инструменты под его контролем. Это позволяет избежать травмирования соседних органов, устранить риски осложнений и сократить период реабилитации.
Пластика почки при гидронефрозе может проводиться с использованием нескольких методов. Самым популярным является «по Хайнс-Андерсену». Такая методика заключается в отсечении части лоханки и самого мочеточника выше и ниже образовавшегося препятствия. После этого участки сшиваются, а в мочеточник вводится катетер-стент. Он будет обеспечивать отвод мочи на протяжении нескольких недель после вмешательства.
Хирург заканчивает лапароскопическую пластику дренированием. Инструменты извлекаются из полости, а кожа зашивается.
Возможные осложнения во время операции
При пластике ЛМС возможны следующие осложнения:
- Повреждения соседних органов . Такое осложнение встречается в крайне редких случаях, так как хирург имеет полный обзор информационного поля
- Занесение инфекции . Для предотвращения этого осложнения перед пластикой почки при гидронефрозе и после нее пациентам вводятся антибактериальные препараты широкого спектра действия. Занесение инфекции возможно только при нарушении правил гигиены в операционной, что практически исключено
- Кровотечение. Риски кровопотери при вмешательстве невелики. Благодаря этому переливание крови пациентам требуется в крайне редких случаях
- Послеоперационная грыжа . Это осложнение также встречаются редко. Это обусловлено тем, что отверстия при вмешательствах являются крошечными
- Конверсия . В некоторых случаях (обычно при обнаружении спаечных процессов или кровотечении) хирург вынужден изменить методику выполнения вмешательства с лапароскопического на открытое
Пластика мочеточника при гидронефрозе: послеоперационный период
После вмешательства пациента переводят в отделение реанимации и интенсивной терапии. Наблюдение за прооперированным ведет анестезиолог-реаниматолог. Врач контролирует основные параметры жизнедеятельности организма. Отслеживаются показатели ЧСС (частоты сердечных сокращений), артериальное давление, температуру, дыхание и количество выделяемой мочи. Врач контролирует и отделяемого по дренажам, а также общее самочувствие пациента.
Как правило, после лапароскопической пластики гидронефроза пациенты жалуются на:
- Боль в области раны . Обычно болевой синдром является слабо выраженным и не мешает пациенту. Если боли сложно терпеть, можно принимать обезболивающие препараты
- Тошноту . Обычно она является реакцией на средства, используемые для анестезии, и быстро проходит
- Неудобства, доставляемые катетером , используемого для контроля цвета и количества мочи. Пациенту нужно лишь немного потерпеть. Этот катетер будет удален на второй день
Что делать в послеоперационном периоде?
Обычно в клинике пациент находится 3-4 дня. На следующий день после пластики мочеточника при гидронефрозе пациенту можно самостоятельно вставать, принимать пищу и пить.
При хорошем самочувствии выписка проходит на 2-3 день. При выписке пациент получает рекомендации, касающиеся питьевого режима, питания и приема лекарственных препаратов. Также назначается дата контрольного осмотра и полного обследования.
После операции вводятся антибактериальные препараты широкого спектра действия. Благодаря этому сокращаются риски инфицирования раны.
- Тяжелых физических нагрузок
- Подъема тяжестей
- Посещения бани, бассейна и сауны
После операции врач обязательно определяет даты консультаций и приемов с целью:
- Удаления швов
- Извлечения стента
- Сдачи анализов крови и мочи
- Проведения УЗИ и КТ (компьютерной томографии)
По результатам проводимых обследований специалист будет оценивать эффективность проведенного вмешательства.
Преимущества обращения в МЕДСИ
- Опыт врачей . Наши специалисты являются членами российской, европейской и американской урологических ассоциаций, работающие в строгом соответствии с международными стандартами диагностики и лечения урологических заболеваний. Команда ведущих хирургов во главе с профессором Котовым С. В., заведующим кафедрой урологии Российского национального исследовательского медицинского университета имени Н. И. Пирогова, оказывает полноценную поддержку каждому пациенту
- Возможности для быстрого проведения операции. При наличии у пациента всех анализов вмешательство назначается на 1-2 день после первого обращения. Также в клинике можно за день пройти все необходимые обследования
- Щадящие методики оперативного лечения . Лапароскопия, например, гарантирует быстрое выздоровление и короткие сроки стационарной терапии
- Высокотехнологичные операционные . Они оснащены инновационным оборудованием ведущих мировых производителей (последними версиями лапароскопического оборудования)
- Возможности для сохранения почки даже у «безнадежных» больных. Это обеспечивается современным оборудованием и опытом врачей
- Высокотехнологичный стационар . В палатах МЕДСИ пациентам предоставляется сбалансированное трехразовое питание и круглосуточный уход медицинского персонала. Все помещения оснащены необходимой мебелью и бытовой техникой. Пациент получает комфорт и высочайший уровень сервиса
- Международные стандарты безопасности JCI . Благодаря им сокращаются все риски операционных и послеоперационных осложнений, сокращается время реабилитации
- Индивидуальный подход к каждому пациенту. Мы понимаем, что одинаковых больных не существует даже при одном диагнозе и всегда учитываем это при оперативных вмешательствах
Оперативное вмешательство давно стало эффективной методикой для восстановления целостности и функциональности внутренних органов. Пластика мочеточника - это одна из тех операций, когда можно вернуть правильное функционирование мочевыделительной системы. Какие методики вмешательства бывают, как подготовиться и как пройти курс реабилитации?
Показания и противопоказания
На сегодняшний день операция по пластике имеет несколько важных показаний:
- пластика проводится в случае наличия обструкции (препятствий) для оттока мочи из почки;
- повреждения мочеточников в ходе оперативных вмешательств;
- повреждения после онкологических заболеваний мочеполовой системы и их лечения.
Повреждения чаще всего наблюдается у женщин в ходе нарушений родовой деятельности, удаления миомы матки. Также врачи считают абсолютным показателем для проведения пластики гидронефроз и гидроуретеронефроз. При гидронефрозе увеличивается давление внутри почки. Проводится пластика лоханочно-мочеточникового сегмента. Если оперируется лоханочно-мочеточниковый сегмент, то вмешательство предполагает осмотр всего участка и дробление камней.
 Гидроуретеронефроз является показанием к проведению пластики.
Гидроуретеронефроз является показанием к проведению пластики.
Гидроуретеронефроз характеризуется препятствием для оттока мочи в области чашечно-лоханочной системы и в самом мочеточнике. Патология (стриктура) возникает при закупорке мочеточника. Еще одним показанием к проведению пластики являются свищи. Они возникают при травмировании мочеточников в ходе проведения полостных вмешательств.
Противопоказаниями к проведению любого вмешательства являются следующие патологии и заболевания:
- нарушение свертываемости крови;
- не вылеченные инфекции;
- беременность;
- сахарный диабет;
- заболевания сердечно-сосудистой системы.
Кроме перечисленных противопоказаний, процедура может быть отклонена и по другим показателям. Поэтому важно пройти обследование и правильно подготовиться к ней. В этот период врач учитывает все факторы, принимает во внимание результаты исследований и принимает решение. Если решение положительное, то начинается период подготовки.
Хирургическое вмешательство
Процедура представляет собой замену части выводящей трубки аутотрансплантантом. Она проводится только при серьезном , когда другие методики лечения не принесли ожидаемых результатов. Выбор метода проведения вмешательства подбирается в соответствии с индивидуальными показателями больного, которые выявляются в ходе подготовки.
Подготовка к пластике
 Расшифровка анализа на свертываемость крови необходима для диагностики болезни и проведения пластики мочеточника.
Расшифровка анализа на свертываемость крови необходима для диагностики болезни и проведения пластики мочеточника.
Операция на мочеточниках требует от врача провести тщательное обследование состояния здоровья пациента. В том числе выявляются инфекции мочеполовой системы. При их обнаружении врач назначает соответствующее лечение. Кроме того, пациент должен сдать анализ крови на свертываемость и другие показатели. Важным этапом обследования является выявление аллергических реакций на те или иные препараты, которые могут использоваться в ходе вмешательства и в период реабилитации. Еще один этап - это бактериологическое исследование. Если анализы и обследования пройдены успешно, инфекции вылечены, врач назначает дату оперативного вмешательства.
Операция и методы ее проведения
Вмешательство проводится под общим наркозом, поэтому анестезиолог осматривает больного и подбирает дозу наркоза, проверяет реакцию больного на те или иные препараты. Также врачи устанавливают катетер, который будет способствовать выведению мочи во время вмешательства и несколько дней после нее. И только после этого врач приступает к работе с мочеточником.
Сегодня вмешательство производится несколькими способами:
- мочеточник заменяется тканями кишечника;
- ткани для замены берутся с мочевого пузыря;
Также возможна методика сшивания мочевыводящего пути после удаления пораженной части. Этот метод возможен только при удалении небольшой части поврежденного пути вывода мочи. Если повреждение находится в нижней части, то врач производит соединение здоровой ткани мочеточника к мочевому пузырю.
Кишечная пластика (частичное и полное замещение) мочеточника
 Хирургическое вмешательство показано при необходимости полной замены поврежденного участка.
Хирургическое вмешательство показано при необходимости полной замены поврежденного участка.
Кишечная пластика представляет собой фронт работ по формированию части мочевыводящего пути из изолированного сегмента кишечника, в частности, используется тонкий кишечник. В ходе работы хирург с помощью катетера формирует из сегмента кишки мочеточник нужного размера и сшивает его с чашечно-лоханочной системой почки и мочевым пузырем. Данная методика используется при необходимости полной замены поврежденного участка.
При частичной пластике используется все тот же отрезок изолированной кишки и сшивается с оставшимися здоровыми частями мочеточника. При этом катетер, используемый в ходе процедуры, выводится наружу. Он будет служить временным мочеточником, пока не наступит полное заживление всех тканей. Частичная пластика позволяет устранить опухоли или спаечные процессы на небольших участках. Также данное вмешательство используют и для устранения больших по площади повреждений мочеточника. Операция по Боари заключается в реконструкции мочеточника лоскутом мочевого пузыря.
Данная методика вмешательства применяется для восстановления целостности мочеточников. Суть вмешательства состоит в том, что трубка мочеточника формируется из ткани из стебля мочевого пузыря. В мочеточник вводят пластиковую трубку и фиксируют ее. После этого из стенки мочевого пузыря иссекается часть ткани с шириной 2−2,5 мм. Длина этого отрезка должна быть больше, чем длина пораженного участка мочеточника. Это нужно для того, чтобы избежать последующего сжатия мочеточника.
Операция по Боари предполагает возможность пластики обоих мочеточников при двухстороннем поражении. Для этого выкраивают сразу 2 отрезка или 1 широкий. Из них врач формирует трубки и вшивает вместо пораженных участков. Участок мочевого пузыря, где были взяты ткани, ушивается хирургом наглухо. Катетер или трубка выводится по мочеиспускательному каналу наружу. В ходе вмешательства хирург дополнительно ставит дренаж в мочевой пузырь.
1702 0
Хирургическое лечение - основной метод лечения гидронефроза (ГН) . Разработка и применение органосохраняющих операций при ГН начались в конце XIX в. После 1889 г., когда был впервые выполнен боковой обходной анастомоз между мочеточником и лоханкой, предложено свыше 60 операций и их модификаций, направленных на восстановление оттока мочи, нарушенного вследствие стеноза лоханочно-мочеточникового сегмента (ЛМС) .
Хирурги накапливают опыт применения малоинвазивных операций, совершенствуют оперативную технику и методы дренирования верхних мочевых путей (ВМП) , проводят лапаро- и ретро-перитонеоскопические коррекции заболевания. Однако при всем многообразии выбора по-прежнему незыблемыми остаются принципы реконструктивной хирургии ГН - обязательное удаление суженного, рубцово-измененного ЛМС с последующим созданием проходимого функционального пиелоуретероанастомоза.
В настоящее время крайне редко выполняют паллиативные операции (уретеролиз, резекция сегментарных сосудов и др.), поскольку достоверно доказано, что длительное сдавлен не лоханки и мочеточника приводит к нервно-мышечным расстройствам в пиелоуретеральном сегменте и верхнем отделе мочеточника, циркулярному истончению стенки мочеточника, атрофии мышечных волокон и разрастанию соединительной ткани. Все это препятствует восстановлению нормальной уродинамики в послеоперационном периоде.
Широко применяемые ранее пластические операции на пиелоуретеральном сегменте (по Фолею, Кальп-де-Вирду, Альбаррану и др.) в настоящее время редки. Наибольшее распространение ввиду патогенетической обоснованности и хороших функциональных результатов получили операция Андерсена-Хайнса и резекция ЛМС с формированием уретеропиелоанастомоза. С 80-х гг. прошлого века для лечения обструктивных заболеваний мочеточника применяют эндоурологические вмешательства - уретеротомию, баллонную дилатацию стеноза и др. В настоящее время идет накопление клинического материала, разработка показаний и противопоказаний к эндоурологическим операциям, осмысление начального опыта и изучение отдаленных результатов.
Несмотря на постоянный интерес к проблеме стеноза ЛМС и ГН, многие вопросы диагностики и лечения больных на разных стадиях болезни еще недостаточно изучены. В научной литературе точки зрения на эти вопросы порой противоречивы. Следует признать, что со времени проведения IX Всероссийского съезда урологов в 1997 г. хирургия гидронефроза существенно изменилась. Это обусловлено как ранней диагностикой заболевания, так и значительным развитием высокотехнологичных и высокоточных методов диагностики и лечения.
Общепринято, что оперировать необходимо больных со II и III стадиями ГН. При выявлении I (начальной) стадии заболевания за больным наблюдают и проводят консервативное лечение. Показания к хирургической коррекции - признаки прогрессирования процесса или появление осложнений. По-прежнему преобладает точка зрения, что для получения благоприятных результатов лечения больных стенозом лоханочно-мочеточникового сегмента и ГН необходимо удаление измененного участка ВМП с пиелоуретеростомией. Среди множества методов наибольшее распространение получила патогенетически объяснимая операция Андерсена-Хайнса.
До сих пор нет единого мнения по ряду принципиальных вопросов реконструктивной хирургии ГН:
- всегда ли следует удалять ЛМС или можно ограничиться паллиативной операцией;
- каков объем резекции лоханки при различном строении чашечно-лоханочной системы и степени ретенции ВМП;
- обоснована ли антевазальная пластика при наличии добавочного сосуда, располагающегося в зоне ЛМС;
- показания и противопоказания к малоинвазивным эндоскопическим вмешательствам на ВМП;
- метод и длительность дренирования верхних мочевых путей при той или иной стадии заболевания.
- устранение причины болезни;
- восстановление функциональной проходимости мочевых путей полноценными тканями;
- восстановление функционального механизма формирования порции мочи и перемещение его в сторону мочевого пузыря;
- приведение в соответствие объемов чашечек и лоханки (при внепочечной лоханке).
К настоящему времени хирургия ГН представлена тремя направлениями:
- открытые реконструктивно-пластические операции - различные варианты уретеропиелоанастомоза с удалением или без удаления суженного участка, лоскутные пластические операции, уретерокаликоанастомоз и др.;
- эндоурологические операции с использованием чрескожного и трансуретрального доступов - бужирование, баллонная дилатация, эндоскопическое рассечение стриктуры (эндотомия);
- лапароскопические и ретроперитонеоскопические пластические операции.
Реконструктивно-пластические операции
Реконструктивные и пластические операции при врожденном сужении лоханочно-мочеточникового сегмента можно разделить на четыре группы:- обходные лоханочно-мочеточниковые анастомозы;
- операции продольного рассечения стенозированного участка с последующим наложением поперечного шва или интубацией мочеточника;
- пластика суженного ЛМС лоскутом, выкроенным из стенки почечной лоханки;
- удаление измененного участка лоханки и мочеточника с последующим наложением пиелоуретерального анастомоза - операция Андерсена-Хайнса.
Для люмботомического (подреберного) доступа больного укладывают на бок в положение для люмботомии. Разрез начинают от верхушки XII ребра, затем спереди закругляют разрез книзу и заканчивают латеральнее прямой мышцы живота и выше пупка. Ободочную кишку мобилизуют медиально. При двустороннем поражении два отдельных подреберных разреза предпочтительнее одного лапаротомного. При повторной операции производят новый разрез на одно ребро выше предыдущего и подходят к зоне вмешательства, направляясь от нормальных тканей к рубцово-измененным. Устанавливают ранорасширитель.
Для торакотомии больного укладывают на бок в положение для люмботомии с выдвинутым поясничным валиком и опущенными головным и ножным концами стола. Разрез обычно начинают в XI межреберье с продолжением по ходу межреберья до прямой мышцы живота. При мини-доступе разрез, начинаясь в XI межреберье по передней подмышечной линии, увеличивается на 3-7 см. В случае мини-доступа с использованием ретроперитонеоскопа-ретрактора и специальной хирургической техники длина разреза составляет 3-4 см. При высоком расположении почки возможна торакотомия в X межреберье.
При доступах в межреберьях возможность операций на почке значительно расширяется за счет лучших пространственных характеристик операционной раны.
Вскрывают фасцию Героты по боковой поверхности почки, сохраняя задний листок фасции с околопочечной клетчаткой, которой в дальнейшем укрывают зону пластики. Остро и тупо забрюшинно разделяют ткани, поворачивая правую почку по часовой стрелке, а левую против часовой стрелки, и обнажают заднюю поверхность почечной лоханки.
Если не планируют резекцию мочеточника и смещение почки книзу, почку выделяют минимально, не отделяя околопочечную жировую клетчатку, за которую в дальнейшем можно подтягивать и поворачивать почку. Ассистент тупфером смещает нижний полюс почки кверху и кпереди, обнажая заднюю поверхность ЛМС. Выделяют мочеточник ниже ЛМС, стараясь не повредить сосуды, идущие к мочеточнику с медиальной стороны. Мочеточник следует мобилизовать на минимальном протяжении, сохраняя адвентицию с питающими его сосудами.
Пальпаторно и визуально определяют наличие и расположение добавочных сосудов, кровоснабжающих нижний сегмент почки. Добавочные нижнесегментарные сосуды, проходящие вне зоны расположения будущего пиелоуретероанастомоза при условии физиологического расположения почки, не резецируют. При иных обстоятельствах тактика индивидуальна и зависит от калибра сосудов и объема питающейся ими паренхимы, а также от типа кровоснабжения почки.
При высоком отхождении мочеточника от лоханки, особенно если почечная лоханка по форме напоминает коробку, можно выполнить V-пластику по Фолею.
При протяженном и низкорасположенном стенозе ЛМС, когда после его удаления образуется значительный дефект и последующее формирование пиелоуретероанастомоза может сопровождаться натяжением швов, используют методики Кальп-де-Вирда или Скардино-Принса, которые позволяют адекватно сопоставить мочеточник с лоханкой.
Для определения зоны наибольших изменений в мочеточнике и лоханке ее заполняют изотоническим раствором натрия хлорида либо индигокармином по тонкой игле и отмечают афункциональный участок ВМП, подлежащий удалению.
Резекция лоханки, верхней трети мочеточника с формированием пиелоуретероанастомоза (модификация Андерсена-Хайнса)
На мочеточник в зоне его выхода из лоханки накладывают шов-держалку. Мочеточник пересекают в косом направлении, затем продольно рассекают по латеральной или передней стенке (в бессосудистой зоне) на протяжении, равном по длине предполагаемому V-образному лоскуту. Более точно разрез можно выполнить после выкраивания лоскута из почечной лоханки.Начинают резекцию лоханки и верхней трети мочеточника коротким разрезом скальпелем с крючковидным лезвием № 11 вдоль одной из ранее намеченных линий. Продолжают резекцию, разрезая лоханку ножницами между швами-держалками. Измененный ЛМС, прилоханочный отдел мочеточника и измененную часть лоханки удаляют (рис. 4.1).
Вводят хлорвиниловую трубку подходящего размера в мочеточник для защиты его задней стенки от захвата в шов при наложении анастомоза. Накладывают шов синтетической рассасывающейся нитью 4/0-6/0, прошивая снаружи внутрь верхушку V-образного лоскута, затем изнутри наружу угол разреза мочеточника. Второй шов накладывают на расстоянии 0,2 см от первого. Оба шва завязывают 4-5 узлами, концы нитей срезают. Шов-держалку на мочеточнике оставляют для облегчения манипуляций.
Не следует захватывать ткани пинцетом. При альтернативном способе накладывают матрацный шов нитью с двойной иглой и после завязывания шва одной иглой ушивают заднюю стенку анастомоза со стороны просвета, другой - переднюю стенку снаружи. Стежки следует делать через мышечную оболочку и адвентицию, стараясь меньше захватывать в шов слизистую оболочку.
Непрерывный шов задней линии анастомоза продолжают до верхушки мочеточника, внахлест на каждом 4-5-м стежке. Аналогичным образом ушивают переднюю линию анастомоза, при этом вымывают из чашечно-лоханочной системы (ЧЛС) сгустки крови, что особенно важно при переднем доступе.
Рисунок 4.1. Схема этапов операции Андерсена-Хайнса
Обе нити у верхушки мочеточника завязывают, одну из них срезают, а другой ушивают оставшийся дефект почечной лоханки. Если необходимо использовать пиелоуретеростому (хлорвиниловую трубку), то ее конец выводят наружу через почечную паренхиму. При необходимости нефростомической трубки ее устанавливают до ушивания почечной лоханки. В настоящее время все чаще применяют стентирование ВМП. При альтернативном способе накладывают кисетный шов дополнительной нитью вокруг центрального треугольного дефекта, начиная от верхнего угла.
Тонкой иглой прокалывают стенку лоханки и вводят изотонический раствор натрия хлорида для проверки герметичности швов и проходимости анастомоза. Если тонкая хлорвиниловая трубка, введенная в лоханку в начале операции, еще не удалена, ее подсоединяют к шприцу и, подняв его на 100 мм, заполняют самотеком ЧЛС раствором. На негерметичный участок накладывают дополнительно 1-2 шва. При недостаточном кровоснабжении тканей, а также при повторной oперации зону пластики укрывают лоскутом сальника.
Устанавливают резиновый или хлорвиниловый дренаж и фиксируют его рядом с анастомозом так, чтобы трубка не касалась линии швов и мочеточника ниже анастомоза. Этого можно добиться фиксацией длинным швом. В качестве альтернативы можно использовать дренажную систему для активной аспирации. Важно правильно установить дренажную трубку. Если почка мобилизована, то ее подтягивают в прежнее положение и фиксируют с помощью швов; в противном случае нижний полюс почки смешается кпереди и сдавливает мочеточник. Сшивают задний и передний края фасции Героты, изолируя почку и зону пластики от брюшной стенки. Рану послойно ушивают. Дренажную трубку выводят сбоку так, чтобы в положении лежа больной не пережимал её.
Налаживают систему послеоперационного дренирования ЧЛС. В случае бездренажной пластики дренирование мочевого пузыря должно быть более длительным в целях уменьшения давления мочи в зоне пластики.
V-пластика (операция Фолея)
Вначале выделяют мочеточник, сохраняя его адвентицию. Подтягивая за держалку, смещают мочеточник краниально. Между двумя швами-держалками на почечной лоханке намечают длинный разрез в виде буквы V. Стенку лоханки между швами-держалками прокалывают крючковидным лезвием № 11 скальпеля и ножницами делают V-образный разрез, ветви которого по длине равны разрезу мочеточника. На этом этапе операции устанавливают нефростомическую трубку с мочеточниковым катетером-стентом или без него.
Рисунок 4.2. Схема этапов операции Фолея
Верхушку лоханочного лоскута подшивают к углу разреза мочеточника синтетической рассасывающейся питью 7/0 и завязывают нить. В шов следует захватывать по возможности меньше слизистой оболочки (рис. 4.2).
Обе стороны V-образного лоскута герметично сшивают с краями разреза мочеточника узловыми швами синтетической рассасывающейся нитью 4/0 в направлении сверху вниз. При альтернативном способе можно наложить два непрерывных шва, как при формировании пиелоуретероанастомоза после удаления ЛМС. Зону анастомоза укрывают околопочечной жировой клетчаткой. В рану устанавливают дренаж без прилегания к линии швов.
Пластика лоскутом лоханки (операция Кальпа-де-Внрда)
Из расширенной лоханки в косом направлении выкраивают спиралевидный лоскут, после чего разрез продлевают вниз на мочеточник на расстояние, равное длине лоскута. На лоскут накладывают шов-держалку и отгибают его книзу. Задний край лоскута подшивают к латеральному краю мочеточника непрерывным швом синтетической рассасывающейся нитью 4/0 или 5/0 (рис. 4.3).
Рисунок 4.3. Схема этапов операции Кальпа-де-Вирда
Таким же образом сшивают передний край лоскута и почечную лоханку. При модификации Скардино-Принса выкраивают не спиралевидный, а вертикальный лоскут почечной лоханки (рис. 4.4).

Рисунок 4.4. Схема этапов операции Кальпа-де-Вирда в модификации Скардино-Принса
Дренирование, как и при предыдущих операциях, производят путем уретеропиелостомии, нефростомии или стентирования ВМП.
Многолетний клинический опыт показывает, что эффективная операция приводит к улучшению функции почки и уменьшению степени дилатации ЧЛС в ближайшие 1-1,5 года с последующей стабилизацией эффекта. Высокая эффективность резекции лоханки, верхней трети мочеточника по Андерсену-Хайнсу (97,82%) подчеркивает ее патогенетическую обоснованность. Удаление склеротически измененного участка верхних мочевых путей создает полноценный в морфофункциональном отношении лоханочно-мочеточниковый анастомоз.
Все операции, направленные на расширение диаметра склерозированного лоханочно-мочеточникового сегмента - операции типа Фолея, Кальпа-де-Вирда имеют существенный недостаток: в соустье остается рубцовая ткань.
По данным В.А. Григоряна (1998), реконструктивные операции по поводу стеноза ЛМС и ГН приводят к улучшению у 10,5% оперированных больных, к полному восстановлению уродинамики в сроки 3-12 мес - у 82,3%. Полученные положительные результаты сохраняются на протяжении всего многолетнего периода наблюдения, исключая единичные случаи.
Во время операций, предусматривающих удаление суженного ЛМС, почти всегда возникает вопрос, какую часть измененной лоханки следует резецировать. Обычно стремятся удалить максимально большую часть расширенной лоханки для приведения ее размеров к нормальным. Согласно мнению ряда авторов, часть расширенной лоханки необходимо иссечь, так как атоничная стенка приводит к образованию карманов, дискоординации сократительной функции. Однако в результате расширенной резекции лоханки ее объем резко уменьшается, и могут возникнуть уродинамические нарушения вследствие несоответствия нового, уменьшенного объема почечной лоханки объему расширенных чашечек.
Исследованием J. Harish (2003) установлено, что при операции Андерсена-Хайнса необходимо увеличивать зону резекции мочеточника в среднем на 0,8 см из-за преобладания размеров зоны с нарушенной иннервацией над зоной видимого сужения. Вместе с тем проблему расширения резекции лоханки необходимо решать сугубо индивидуально, в зависимости от функционального состояния чашечно-лоханочной системы.
Целесообразность открытых операций по поводу так называемого функционального гидронефроза без удаления ЛМС сомнительна. Учитывая недостаточно удовлетворительные результаты пластических операций на лоханочно-мочеточниковом сегменте без его иссечения, ряд авторов эти операции относит к паллиативным, дающим в основном лишь кратковременный эффект всего у 18-20% больных. Как правило, больных, перенесших органосохраняющие операции без иссечения ЛМС, оперируют повторно, и нефрэктомию выполняют у 41% из них.
Комплексное исследование ЛМС и прилоханочного отдела мочеточника ставит под сомнение термин «функциональный ГН». При интраоперационной электропиелоуретеромиографии проходимый сегмент во всех случаях проявляет низкую биоэлектрическую активность или вовсе «немой».
При гистологическом исследовании проходимого сегмента, который считают характерным для функционального ГН, выявляют дефицит мышечных волокон по всей окружности с распространением на прилоханочный отдел мочеточника (гипоплазия). Межклеточные промежутки утолщены, мышечные клетки разобщены, основной состав - соединительная ткань и коллагеновые волокна. Таким образом, значительные морфологические изменения ЛМС объясняют патогенез ГН.
Необратимость структурных изменений обосновывает целесообразность резекции лоханки и верхней трети мочеточника с удалением измененного ЛМС и созданием полноценного в морфофункциональном отношении лоханочно-мочеточникового анастомоза.
Практическую значимость интраоперационной электропиелоуретеромиографии подчеркивают многие исследователи. Некоторые авторы считают ее единственным методом, который определяет зону акинезии лоханочно-мочеточникового сегмента при динамической (функциональной) обструкции у больных гидронефрозом, когда отсутствуют механические препятствия оттоку мочи. Нарушение уродинамики ВМП обусловлено расстройством координированной деятельности лоханки, ЛМС и мочеточника.
Подобные физиологические исследования в ходе операции встречают определенные трудности, так как требуют технического обеспечения и участия специалистов по функциональной диагностике. По мнению Ю.А. Пытеля (1997), гораздо более информативный метод - индигокарминовая проба, заключающаяся в наполнении лоханки раствором индигокармина до достижения в ней порогового давления и наблюдении за волнами сокращения лоханки и мочеточника.
Важнейшее условие - предварительное опорожнение ЧЛС, что позволяет составить истинное представление о топографических взаимоотношениях между лоханкой, мочеточником и почечными сосудами. Кроме того, если тонус лоханки достаточный, то после опорожнения она значительно уменьшается и принимает свою реальную форму и размеры.
По мнению Ю.Г. Аляева, В.А. Григоряна и соавт. (2008), расширенная резекция лоханки показана при поздних стадиях ГН с выраженными структурно-функциональными изменениями ВМП. У больных с гигантской ЧЛС для раннего и полноценного восстановления уродинамики целесообразно удаление всего афункционального участка лоханки. Границы резекции лоханки и верхней трети мочеточника следует устанавливать после опорожнения ЧЛС. Зона резекции лоханки может быть определена по границам распространения волны сокращения в ответ на раздражение сохранной части лоханки пинцетом.
При необходимости возможно применение индигокарминовой пробы. Она позволит определить не только область стриктуры, но и афункциональный участок (обычно протяженностью 0,1-0,3 см), дистальнее которого четко видны волны сокращения мочеточника. Эта зона оптимальна для удаления, причем пересечение мочевых путей выполняют на 0,5-0,6 см дистальнее и проксимальнее афункционального участка.
По данным Р.Х. Галеева (2001), выбор реконструктивной операции при добавочном сосуде зависит от предоперационного сосудистого исследования. Автор предлагает использовать перемещение дополнительного сосуда по лоханке без его пересечения или транспозицию пополнительной почечной артерии на более высокий уровень по аорте.
Ряд авторов рекомендует при ГН, возникшем на фоне нижнесегментарного сосуда, при отсутствии рубцового сужения ЛМС ограничиться антевазальным пиелопиелоанастомозом без удаления отрезка ВМП. Однако большинство хирургов критически относятся к антевазальной пластике верхних мочевых путей и при выявлении дополнительного сосуда его резецируют вместе с нижним сегментом почки и обязательно удаляют ЛМС с последующим уретеропиелоанастомозом.
Нижнесегментарные артерии, проходящие как спереди, так и сзади от мочеточника, всегда влияют на состояние окружающих тканей и мочеточника. Многое в этой ситуации определяется толщиной парапельвикальной клетчатки, подвижностью почки, адекватностью венозного оттока, диаметром нижнесегментарных сосудов и местом их впадения в почку. Воздержаться от резекции добавочного сосуда можно при условии расположения его вне зоны сформированного уретеропиелоанастомоза. При этом уретеровазальную топографию следует оценить исключительно после придания почке и ВМП физиологического положения.
При добавочном нижнеполярном сосуде у взрослых недостаточно ограничиться резекцией или перемещением сосуда; как правило, приходится выполнять реконструктивную операцию на соустье вследствие рубцовых изменений, вызванных многолетним контактом с сосудом.
Реконструктивные операции при добавочных или нижнесегментарных сосудах всегда остаются отдельной страницей хирургического лечения больных ГН. До сих пор дискутабельно, приводят ли нижнесегментарные сосуды к гидронефрозу или изменения стенки лоханочно-мочеточникового сегмента носят автономный характер.
Независимо от причины возникновения ГН современные рекомендации однозначны:
- при нижнесегментарном сосуде и ГН недостаточно резецировать или перемещать сосуд; как правило, необходима реконструктивная операция на ВМП;
- при сохранении нижнесегментарных (добавочных) сосудов положение их не должно быть в зоне уретеропиелоанастомоза.
В урологической клинике ММА им. И.М. Сеченова при первичном гидронефрозе со структурно-функциональными изменениями верхних мочевых путей предпочитают открытые реконструктивные операции с целью максимально полного удаления афункциональной ткани. Резекция лоханки, верхней трети мочеточника, уретеропиелостомия и операция Андерсена-Хайнса патогенетически обоснованны. Преимущества этих методик перед другими вариантами реконструкции ВМП подтверждены отличными функциональными отдаленными результатами лечения больных ГН.
Больная М., 36 лет, поступила в урологическую клинику ММА им. И.М. Сеченова с жалобами на периодически возникающую боль в поясничной области справа. В течение нескольких лет неоднократно лечилась от воспалительных заболеваний нижних мочевых путей с переменным успехом.
При осмотре живот не вздут, при пальпации мягкий, безболезненный. Поясничная область не изменена. Почки не пальпируются. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание безболезненное, свободное. Анализы крови и мочи без особенностей.
УЗИ: правая почка размерами 11,0x5,5 см; паренхима однородная, толщина 1,8 см: подвижность нормальная; лоханка расширена, размерами 2,3x2,7 см; чашечки - верхняя 1,5 см, средняя и нижняя по 1,0 см. Левая почка без особенностей. При эходопплерографии существенных отклонений не выявлено, параметры кровотока симметричны.

Рисунок 4.5. А - эхограмма правой почки больной М., расширение чашечно-лоханочной системы; Б - эходопплерограмма правой почки, отсутствие нарушений органного кровотока
Динамическая нефросцинтиграфия: ренограммы обтурационного типа за счет задержки индикатора в чашечно-лоханочной системе с обеих сторон. ДПФ: правая почка - 42%.
Для оценки состояния ЧЛС справа, паренхимы почки, ЛМС и периуретеральных тканей, мочеточника на всем протяжении, а также для определения вазоурстерального конфликта выполнена мультиспиральная компьютерная томография (МСКТ) с трехмерной визуализацией: почки обычно расположены, нормальных размеров и формы с четкими, ровными контурами; паренхима почек однородна, обычной плотности; слева чашечки до 0,5 см, лоханка 2,1x1,5x2,1 см; справа чашечки расширены до 1,0 см, лоханка размерами 3,3x2,8x3,0 см; справа визуализирован перегиб прилоханочного отдела мочеточника.

Рисунок 4.8. Мультиспиральные компьютерные томограммы почек той же больной, виртуальная эндоскопия: А - карта-схема; Б - вид из лоханки на суженный лохапочно-мочеточниковый сегмент (указано стрелкой); В - перегиб прилохапочного отдела мочеточника (вид из мочеточника)
Для оценки состояния парауретеральных тканей выполнено эндолюминальное УЗИ ВМП справа: склероз парауретеральной клетчатки, протяженность стеноза ЛМС >1,5 см. Диагноз: ЛМС справа, ГН; хронический цистит. Операция: резекция лоханки, верхней трети мочеточника справа, уретеропиелостомия, биопсия почки.
В ходе операции установлено, что паранефральная клетчатка истончена, склеротически изменена, богата варикозными венулами. Почка с ровной поверхностью, розового цвета, эластичной консистенции. Лоханка внепочечного типа, расширена до 4,5 см, стенка ее белесая, ригидная. Лоханка сокращается и опорожняется плохо. Парапельвикальная клетчатка истончена, плотно припаяна к стенке лоханки. Верхняя треть мочеточника на протяжении 2,0 см интимно тоже спаяна с ней.
На поверхности лоханки и верхней трети мочеточника варикозно расширенные вены. Удалена афункциональная часть ВМП длиной 2,5 см. Удаленный лоханочно-мочеточниковый сегмент сужен до 0,2 см в диаметре, белесый, склеротически изменен, дистально мочеточник диаметром до 0,5 см, перистальтика его сохранена. Наложен уретеропиелоанастомоз 4 П-образными и непрерывными швами между ними. При медикаментозной полиурии дилатация лоханки не возникает, анастомоз герметичен.

Рисунок 4.9. Этапы операции: А - мобилизация лоханки, лоханочно-мочеточникового сегмента и верхней трети мочеточника (последняя интимно прилежит к стенке лоханки); Б - окончательный вид сформированного уретеропиелоанастомоза (лоханка переходит в верхнюю треть мочеточника без перегибов)
Гистологическое исследование почечной паренхимы: умеренно выраженное расширение просвета капсулы отдельных клубочков и отдельных канальцев. ЛМС с признаками склероза. Плотность упаковки клубочков (ПУК) - 0,059, СМК - 1,25.
При обследовании через 4 мес после операции дилатации ЧЛС и нарушений органного кровотока не выявлено. RI почечной паренхимы - 0,6.

Рисунок 4.11. Правая почка. Эходопплсрограмма
У больной с неустановленной длительностью заболевания и расширением лоханки до 3,3x2,8x3,0 см (данные МСКТ) в ходе предоперационного обследования выявлен фиксированный коленообразный перегиб лрилоханочного отдела мочеточника. Удаление значительного участка верхней трети мочеточника и лоханки и создание функционального анастомоза восстановило функцию почки через 4 мес после операции (табл. 4.1).
Таблица 4.1. Показатели функции почки до и после операции больной М.

В подобных клинических ситуациях малоинвазивные операции (ретроградное или антеградное бужирование, баллонная дилатация или эндопиелотомия) не оправданы. Они могут привести к клинической неудаче ввиду топографических (коленообразный изгиб, избыток верхней трети мочеточника) и патогистологических (склеротические изменения ЛМС, прилоханочного отдела мочеточника и стенки лоханки) изменений верхних мочевых путей.
Собственный клинический опыт каждого хирурга - причина расхождения мнений по вопросам кишечной пластики мочеточников , определению показаний к ней, выбору доступов и методов восстановления непрерывности мочевого тракта, влиянию кишечной пластики на гомеостаз. Тяжесть состояния больных уретерогидронефрозом (двусторонним или единственной почки), значительная перестройка мочевого тракта, возможность послеоперационных осложнений со стороны мочевыводящих путей, желудочно-кишечного тракта и сопутствующих заболеваний сдерживают широкое внедрение кишечной пластики мочеточников в клинике.
По данным B.C. Карпенко (2002), успешная одноэтапная кишечная пластика мочеточников при обструктивном уретерогидронефрозе по результатам клиренс-тестов уже к исходу 3-й недели дает улучшение функции почек на 12+2,5%. Кишечная пластика мочеточника показана при двустороннем уретерогидронефрозе, ГН единственной почки, свищах мочеточника, протяженных и рецидивных стриктурах мочеточника. Она может быть альтернативой нефруретерэктомии.
Тотальная илеопластика мочеточника выполнена у трех больных по поводу множественных его стриктур и уретерогидронефроза. Хорошие результаты получены у двух из них.
П.В. Глыбочко, Ю.Г. Аляева
рентген аппарат купить на сайте Фуджитора