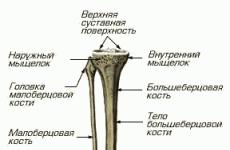
8 бактериологический метод исследования его этапы. Этапы бактериологического метода исследования. Рецепторный комплекс наивных лимфоцитов
20. Характеристика бактериологического метода исследования
Культуральный (бактериологический) метод исследования - совокупность способов, направленных на выделение и идентификацию чистых культур микроорганизмов (бактерий) с помощью культивирования на питательных средах.
Чистая культура - совокупность микроорганизмов одного вида. Чаще всего чистую культуру получают путем отбора и культивирования изолированной колонии (потомство одной микробной клетки).
Этапы метода:
1. Забор материала для исследования.
2. Выделение чистой культуры и ее идентификация.
3. Заключение.
Забор материала для исследования. Вид исследуемого материала зависит от цели исследования (диагностика - от больного; эпиданализ - из внешней среды, продуктов питания, больного и (или) бактерионосителя).
Выделение чистой культуры . Включает 3 или 4 этапа:
1. Посев материала (после предварительной микроскопии) на чашку с плотной питательной средой (лучше дифференциально-диагностической или селективной) с целью получения изолированных колоний. Производят его чаще всего методом механического разобщения. В некоторых случаях (например, кровь) материал предварительно засевают в жидкую среду обогащения с последующим пересевом на чашку с агаровой средой. Иногда до посева проводят селективную обработку материала (с учетом свойств выделяемого микроорганизма; например, обработка кислотой или щелочью для выделения устойчивых бактерий). Культивируют при температуре 37°С в течение 18-24 часов. Время культивирования для разных видов бактерий может колебаться.
2(3):а) изучение колоний на чашке с агаром (культуральные признаки), отбор наиболее типичных; б) приготовление мазков из этих колоний с окраской (по Граму или другими методами); а) отсев остатка исследованной колонии на среду накопления и выращивание в термостате при оптимальной температуре.
3(4). Изучение чистоты культуры, полученной на среде накопления. С этой
целью готовят мазок, окрашивают (чаще по Граму), микроскопически изучают
морфологическую и тинкториальную однородность (в разных полях зрения).
4(5). Идентификация чистой культуры.
Заключение. По совокупности признаков в сравнении со свойствами эталонных (типовых) штаммов указывается вид выделенного из материала микроорганизма.
Оценка метода:
достоинства: относительно высокая чувствительность и точность, возможность определить численность микробов в исследуемом материале, а также чувствительность к антибиотикам;недостатки: относительная длительность, метод дорогостоящий.
21. Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
Требования:
среды должны быть питательными
должны иметь определенные ph
должны быть изотоническими, т.е. осмотическое давление в среде должго быть такое же как в клетке.
должны быть влажными и не слишком жидкими
должны облпдпть определенным окислительно-восстановительным потенциалом
должны быть стерильными
должны быть унифицированными, т.е. содержать постоянные количества отдельных ингредиентов.
Питательные среды можно разделить:
А) По происхождению:
1} естественные - натуральные продукты питания (мясо, молоко, картофель);
2) искусственные - приготовленные специально для выращивания микробов: - среды из естественных продуктов (мясная вода, мясопептонный бульон (МПБ), мясопептонный агар (МПА), - не имеющие постоянного состава; - синтетические питательные среды - растворы строго определенных количеств солей, аминокислот, азотистых оснований, витаминов в дистиллированной воде - имеют постоянный состав, используются для выращивания микроорганизмов и культур клеток при получении вакцин, иммунных сывороток и антибиотиков;
Б) По назначению:
1) общего назначения (МПБ, МПА) - на них растет большинство микробов;
2) элективные - избирательно способствуют росту одного вида микробов из смеси (например, желточно-солевой агар для стафилококков);
3) дифференциально-диагностические - позволяют отдифференцировать по внешнему виду среды один вид микроба от других (например среды Эндо, Левина для кишечной группы микробов).
Кроме того, в зависимости от целей использования в схеме выделения чистых культур, по назначению можно выделить следующие среды:
1) обогащения - подавляют рост микробов, сопутствующих возбудителю;
2) для получения изолированных колоний;
3) накопления чистой культуры;
В) По консистенции:
1) жидкие;
2) полужидкие (при добавлении агар-агара в концентрации 0,5-0,7%);
3) плотные - выше 1%.
Исследование бактерий имеет большое практическое значение для человека. На сегодняшний день открыто большое количество прокариот, которые отличаются друг от друга по патогенности, области распространения, форме, размерам, количеству жгутиков и другим параметрам. Чтобы детально изучить данный штамм, применяется бактериологический метод исследования.
Какие существуют методы клеток?
Чтобы определить, являются ли бактерии патогенными, проводят исследование культуры различными способами. Среди них:
1. Бактериоскопический метод.
2. Бактериологический метод.
3. Биологический метод.
Бактериоскопический и бактериологический основаны непосредственно на работе с клетками прокариот, когда биологический анализ требуется для изучения влияния таких клеток на живой организм подопытных животных. По степени проявления тех или иных признаков заболевания ученый может сделать вывод о наличии или отсутствии патогенных бактерий в пробе, а также естественно их размножить в организме животного для получения их культуры и использования в других работах.
Бактериологический метод исследования отличается от бактериоскопического. В первом для анализа используется специально подготовленная культура живых прокариот, когда во втором проводится работа с мертвыми или живыми клетками на предметном стекле.
Этапы бактериологического метода исследования. Микробиология
Принцип изучения свойств бактериальной культуры может пригодиться как для ученых-микробиологов, которые поставили цель исследовать прокариотические клетки, так и для лаборантов, задача которых заключается в установлении патогенности или непатогенности бактерий, а затем диагноза пациента.
Методика изучения бактерий делится на три этапа:
1. Выделение бактерий из первоначальной пробы.
2. Высевание бактерий и выращивание изучение ее свойств.

Первый этап
Проба, или мазок, берется со свободной поверхности среды или у пациента. Таким образом мы получаем «коктейль» из множества видов бактерий, которые должны высеять на питательную среду. Иногда появляется возможность выделить сразу необходимые бактерии, зная их очаги распространения в организме.
Через двое-трое суток отбираются нужные колонии и высеваются на твердые среды чашек Петри с помочью стерильной петли. Во множестве лабораторий работают с пробирками, где может находиться твердая или жидкая питательная среда. Так и проводится бактериологический метод исследования в микробиологии.
Второй этап
После получения отдельных колоний бактерий проводится непосредственный макро- и микроанализ. Измеряются все параметры колоний, определяется цвет и форма каждой из них. Нередко проводится подсчет колоний на чашке Петри, а затем в исходном материале. Это имеет значение при анализе патогенных бактерий, от числа которых зависит степень заболевания.
Бактериологический метод исследования, 2 этап которого заключается в изучении отдельных колоний микроорганизмов, может быть сопряжен с биологическим способом анализа бактерий. Еще одна цель работы на этом этапе - увеличить количество исходного материала. Это можно сделать на питательной среде, а можно провести эксперимент в естественных условиях на живых подопытных организмах. Патогенные бактерии будут размножаться, и в результате кровь будет содержать миллионы клеток прокариот. Из взятой крови легко приготовить необходимый рабочий материал бактерий.

Третий этап
Самая важная часть исследования - это определение морфологических, биохимических, токсигенных и антигенных свойств культуры бактерий. Работа ведется с заранее «очищенными» культурами на питательной среде, а также с препаратами (зачастую окрашенными) под микроскопом.
Установить принадлежность патогенных или условно-патогенных бактерий к той или иной систематической группе, а также определить их устойчивость к лекарствам позволяет бактериологический метод исследования. 3 этап - антибиотики, т. е. анализ поведения клеток бактерий в условиях содержания лекарственных препаратов в окружающей среде.
Исследование устойчивости культуры к антибиотику имеет важное практическое значение, когда необходимо прописать для конкретного пациента необходимые, а главное, действенные препараты. Здесь и может помочь бактериологический метод исследования.
Что такое питательная среда?
Для развития и размножения бактерии должны находиться в заранее подготовленных питательных средах. По консистенции они могут быть жидкие или твердые, а по происхождению - растительные или животные.
Основные требования к питательным средам:
1. Стерильность.
2. Максимальная прозрачность.
3. Оптимальные показатели кислотности, активности воды и других биологических величин.

Получение изолированных колоний
1. Метод Дригальского. Он заключается в том, что на бактериальную петлю наносится мазок с различными видами микроорганизмов. Этой петлей проводят по первой чашке Петри с питательной средой. Далее, не меняя петлю, методом остаточного материала проводят по второй и третьей чашкам Петри. Так, на последних образцах колонии бактерии будут засеваться не слишком плотно, тем самым упрощается возможность найти необходимые для работы бактерии.
2. Метод Коха. В нем используются пробирки с расплавленной питательной средой. Туда помещается петля или пипетка с мазком бактерий, после чего содержимое пробирки выливается на специальную пластинку. Агар (или желатин) застывает через какое-то время, а в его толще легко обнаружить нужные колонии клеток. Важно перед началом работы развести смесь бактерий в пробирках, чтобы концентрация микроорганизмов не была очень большой.
Этапы которого основаны на выделении нужной культуры бактерий, не обходится без этих двух способов нахождения изолированных колоний.
Антибиотикограмма
Визуально реакцию бактерий на препараты можно заметить двумя практическими способами:
1. Метод бумажных дисков.
2. Разведение бактерий и антибиотика в жидкостной среде.
Метод бумажных дисков требует наличия культуры микроорганизмов, которые были выращены на твердой питательной среде. На такую среду кладут несколько бумажек округлой формы, пропитанных антибиотиками. Если препарат успешно справляется с нейтрализацией бактериальных клеток, после такой обработки останется участок, лишенный колоний. Если же реакция на антибиотик отрицательная, бактерии выживут.
В случае использования жидкой питательной среды сперва готовят несколько пробирок с культурой бактерий разных степеней разведения. В эти пробирки добавляют антибиотики, и в течение суток наблюдают за процессом взаимодействия вещества и микроорганизмов. В конечном итоге получается качественная антибиотикограмма, по которой можно судить об эффективности препарата для данной культуры.

Основные задачи анализа
Здесь перечислены по пунктам цели и этапы бактериологического метода исследования.
1. Получить исходный материал, который будет использоваться для выделения колоний бактерий. Это может быть мазок с поверхности любого предмета, слизистой оболочки или полости органа человека, анализ крови.
2. на твердой питательной среде. Через 24-48 часов на чашке Петри можно обнаружить колонии бактерий разных видов. Отбираем по морфологическим и/или биохимическим критериям нужную и проводим уже с ней дальнейшую работу.
3. Размножение полученной культуры. Бактериологический метод исследования может опираться на механический или биологический способ увеличения численности культуры бактерии. В первом случае ведется работа с твердыми или жидкими питательными средами, на которых в термостате размножаются бактерии и образуют новые колонии. Биологический способ требует естественных условий увеличения численности бактерий, поэтому здесь микроорганизмами заражается подопытное животное. Через несколько суток в пробе крови или мазке можно обнаружить множество прокариот.
4. Работа с очищенной культурой. Чтобы определить систематическое положение бактерий, а также их принадлежность к возбудителям заболеваний, необходимо провести тщательный анализ клеток по морфологическим и биохимическим признакам. При исследовании патогенных групп микроорганизмов важно знать, насколько эффективно действие антибиотиков.
Это была общая характеристика бактериологического метода исследования.

Особенности проведения анализа
Главное правило проведения бактериологического исследования - это максимальная стерильность. Если идет работа с пробирками, посевы и пересевы бактерий должны проводиться только над нагретой спиртовкой.
Все этапы бактериологического метода исследования требуют использования специальной петли или пастеровской пипетки. Оба инструмента должны быть предварительно обработаны в пламени спиртовки. Что касается пастеровской пипетки, то тут перед термической стерилизацией необходимо отломать кончик пипетки пинцетом.
Техника посева бактерий тоже имеет свои особенности. Во-первых, при посеве на твердые среды проводят бактериальной петлей по поверхности агара. Петля, конечно же, уже должна иметь на поверхности образец микроорганизмов. Также практикуется посев внутрь и в этом случае петля или пипетка должны достичь дна чашки Петри.
При работе с жидкими средами используются пробирки. Здесь важно следить, чтобы жидкости не касались краев лабораторной посуды или пробки, а используемые инструменты (пипетка, петля) не дотрагивались до посторонних предметов и поверхностей.

Значение биологического метода исследования
Анализ пробы бактерий имеет свое практическое применение. Прежде всего бактериологический метод исследования может использоваться в медицине. К примеру, необходимо изучить микрофлору больного, чтобы установить правильный диагноз, а также выработать правильный ход лечения. Здесь помогает антибиотикограмма, которая покажет активность лекарственных препаратов против возбудителя заболеваний.
Анализ бактерий используется в лаборатории для определения таких опасных заболеваний, как туберкулез, возвратный тиф или гонорея. Также он применяется для изучения бактериального состава миндалин, полостей органов.
Бактериологический метод исследования можно использовать для определения загрязненности среды. По данным о количественном и качественном составе мазка с поверхности какого-либо предмета определяется степень заселенности данной среды микроорганизмами.
ЦЕЛЬ ЗАНЯТИЯ: знать принципы культивирования микроорганизмов, питательные среды, их классификация; методы стерилизации и дезинфекции, применяемые в микробиологии и медицине; этапы бактериологического метода диагностики инфекционных заболеваний.
уметь пользоваться аппаратурой для культивирования бактерий (аэробов и анаэробов), выбрать средства, режим стерилизации и дезинфекции в соответствии с конкретными задачами, проводить 1 этап бактериологического метода диагностики инфекционных заболеваний (посевы исследуемого материала на плотные и жидкие питательные среды с целью выделения чистых культур аэробных микроорганизмов).
1. Вопросы для самоподготовки:
1. Состав и требования, предъявляемые к питательным средам
2. Классификация питательных сред
3. Асептика и антисептика
4. Дезинфекция, методы и контроль эффективности дезинфекции
5. Стерилизация, методы, аппаратура и режимы стерилизации
6. Методы определения эффективности стерилизации
7. Вид, штамм, колония, чистая культура микроорганизмов
8. Методы выделения чистых культур микроорганизмов
9. Бактериологический метод диагностики инфекционных заболеваний. Цель и последовательность выполнения 1 этапа бактериологического метода выделения аэробов
10. Техника посева микроорганизмов на жидкие и плотные питательные среды
11. Особенности культивирования анаэробных микроорганизмов. Аппаратура и оборудование, используемая для культивирования анаэробных бактерий
2. Контрольные вопросы:
1) Выписать требования, предъявляемые к питательным средам
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2) Выписать классификацию питательных сред
а) по консистенции (с примерами, указать концентрацию агар-агара): ________________________________________________________________________________________________________________________________________________________________
б) по целевому назначению (дать определение, привести примеры)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________
3) Выписать методы стерилизации
а) с использованием высоких температур ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) без использования высоких температур ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4) Перечислить аппаратуру для стерилизации ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5) Выписать в тетрадь а) методы контроля режима стерилизации
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) методы контроля стерильности питательных сред ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) методы контроля стерильности инструментов, перевязочного, шовного материала и др. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6) Перечислить все методы культивирования аэробов
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
7) Перечислить все методы культивирования анаэробов
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
8) Изучить схему бактериологического метода диагностики, назвать этапы метода
Выписать цель и схему бактериологического метода исследования
ЦЕЛЬ БАКТЕРИОЛОГИЧЕСКОГО МЕТОДА
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
СХЕМА БАКТЕРИОЛОГИЧЕСКОГО МЕТОДА
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ознакомиться с питательными средами и заполнить таблицу «Питательные среды».
Заполните таблицу «Основные методы стерилизации»
| Метод стерилизации | Аппаратура | Режим стерилизации: температура, давление, однократно или дробно (сколько раз) и др. | Надежность: полное обеспложивание или остаются жизнеспособные микроорганизмы (споры, вирусы) | Стерилизуемые материалы |
| 1. Прокаливание | ||||
| 2. Кипячение | ||||
| 3. Паровая стерилизация паром под давлением | ||||
| 4. Паровая стерилизация текучим паром | ||||
| 5. Воздушная стерилизация (сухим жаром) | ||||
| 6. Пастеризация | ||||
| 7. Ионизирующая радиация | ||||
| 8. УФ-облучение | ||||
| 9. Фильтрование | ||||
| 10. Газовая стерилизация | ||||
| 11. Химические растворы |
Базовый текст
Состав и требования, предъявляемые к питательным средам
Питательные среды необходимы для получения чистых культур микроорганизмов, изучения особенностей их морфологии и физиологии, а также для сохранения микроорганизмов в виде чистых культур в лабораторных и производственных условиях.
Питательная среда должна удовлетворять следующим требованиям:
1. Питательность (полноценность) - содержание необходимых для жизнедеятельности микробов факторов – источников углерода, азота, серы, источников энергии, необходимых неорганических ионов в форме доступной для усвоения микроорганизмами.
2. Изотоничность, создаваемая 0,85% NaCl (концентрация солей в питательной среде должна соответствовать их концентрации в микробной клетке).
3. Оптимальные значения ряда биохимических показателей: концентрации водородных ионов (диапазон рН 4,5-8,5, обычно 7,2-7,4), окислительно-востановительного потенциала (Eh для анаэробов – низкий 0,0120-0,060 В, для аэробов – высокий более 0,080 В), осмотического давления.
4. Иметь достаточную влажность (не менее 60% для плотных сред), так как микробы питаются по законам диффузии и осмоса.
5. Определенная вязкость (наиболее оптимальная для диффузии веществ).
6. Прозрачность, для визуализации роста бактерий.
7. Стерильность.
Компоненты питательных сред
Источником азота для микроорганизмов являются белки, но большинство микробов неспособны усваивать нативный белок, поэтому используются продукты кислотного и ферментного расщепления белка: пептон, казеин. Исходными компонентами искусственной питательной среды является мясная вода, кислотный и ферментный гидролизат казеина, пептон, также к основе добавляют хлорид натрия. Мясная вода содержит минеральные вещества, углеводы, витамины. Казеин пищевой кислотный является отходом молочной промышленности, содержит полноценный набор аминокислот и характеризуется высокой питательностью. Пептон – это продукт неполного переваривания белка, получаемый путем ферментного или кислотного гидролиза отходов производства мясных или рыбных продуктов или молочного казеина. Содержит альбумозы, пептоны и полипептиды аминокислот в незначительном количестве, состав их зависит от глубины расщепления белка. Пептон представляет собой порошок светло-желтого цвета, хорошо растворяется в воде, не свертывается при нагревании. Используется как источник азота и углерода.
Плотные питательные среды готовят из жидких с добавлением уплотнителя. В качестве уплотнителя обычно применяют агар-агар. Агар-агар – продукт, получаемый из морских водорослей, представляет собой желтоватый порошок или пластинки, содержит высокомолекулярные полисахариды, не расщепляется большинством микроорганизмов, не разрушается при автоклавировании, питательную ценность сред не изменяет, не подавляет рост микробов. Он способен образовывать в воде гели, плавящиеся при 100°С и уплотняющиеся при 45°С и ниже, не используемые микроорганизмами в качестве питательного субстрата. Несколько циклов плавления и затвердевания не влияют на способность агара образовывать гель, поэтому агаровые среды можно несколько раз стерилизовать.
Также в состав питательных сред включают кровь, сыворотки, неорганические соли. Все питательные среды, как правило, содержат 0,5 % хлористого натрия, что соответствует изоосмотическим условиям среды, оптимальным для жизнедеятельности микробов. Функцией минеральных элементов в метаболизме микробов является в основном активация различных ферментов. Кроме того, неорганические ионы (в основном Na+ и К+) участвуют в транспорте веществ через клеточные мембраны, в регуляции синтеза белка.
Восстанавливающие вещества. Восстанавливающие вещества добавляют в среды, предназначенные для культивирования анаэробных микроорганизмов, чтобы снизить окислительно-восстановительный потенциал (Eh) и сбалансировать его на оптимальном уровне. Eh - это мера способности раствора отдавать или принимать электроны. При культивировании анаэробов в качестве восстановителей обычно применяют тиогликолят натрия (0,1 %), цистеин (0.1%), аскорбиновую кислоту (0,1 %).
Углеводы, многоатомные спирты, индикаторы . Углеводы являются наилучшим источником углерода для большинства гетеротрофных микроорганизмов. Они входят в состав дифференциально-диагностических сред, предназначенных для определения биохимических свойств микробов.
В состав питательных сред, кроме углеводов и многоатомных спиртов, входят различные индикаторы , в основном кислотно-основные. Изменение цвета среды при посеве микроорганизмов указывает на образование кислоты или щелочи при ферментативной активности микроорганизмов. В качестве индикаторов обычно используют нейтральный красный, бромтимоловый синий, конго красный, смесь розоловой кислоты и водно-голубого (ВР), индикатор Андреде.
Красители. Способность красителей легко и обратимо переходить из окрашенной формы в восстановленную (бесцветную) широко используется в бактериологической практике, в частности, для дифференциации бактерий, разлагающих лактозу, от лактозоотрицательных. В результате указанного процесса лактозоположительные бактерии образуют на среде окрашенные колонии, а лактозоотрицательные – бесцветны. Наиболее употребительными красителями, входящими в состав питательных сред, являются основной фуксин, метиленовая синь и эозин.
Ингибиторы. При исследовании на наличие патогенных бактерий необходимо подавить рост сопутствующей микрофлоры. С этой целью используют различные ингибиторы. В качестве ингибиторов грамотрицательных микроорганизмов в состав сред входят тетратионат натрия и калия, теллурит калия, ацетат таллия, сульфат таллия, селенит натрия. Для угнетения роста грамположительных микробов используются анилиновые красители: бриллиантовый зеленый, кристаллический фиолетовый, этиловый фиолетовый, анилиновый синий. Желчь и соли желчных кислот входят в состав селективных сред для выращивания патогенных энтеробактерий. Смесь желчных кислот, получаемая в результате щелочного гидролиза желчи, входит в состав среды Плоскирева. За рубежом в составе селективных сред используют соли отдельных желчных кислот, в основном дезоксихолат натрия.
Сухие питательные среды. Приготовление питательных сред - один из наиболее ответственных участков работы бактериологической лаборатории. В связи с этим биопромышленность выпускает стандартные, консервированные, сухие питательные среды, различного назначения, для культивирования микроорганизмов. Они представляют собой гигроскопические порошки с влажностью до 10%. Готовят среды по прописи, указанной на этикетке. Постоянство состава, стандартность среды, простота и удобство в работе, легкость транспортировки и хранения являются большим преимуществом сухих питательных сред. После установления соответствующего рН среду кипятят, фильтруют, осветляют, разливают во флаконы, пробирки и стерилизуют. Следует учитывать, что после стерилизации среда становится более кислой.


 Вид - совокупность микроорганизмов, имеющих общее эволюционное происхождение, близкий генотип (высокую степень генетической гомологии, как правило более 60%) и максимально близкие фенотипические характеристики. Штамм – выделенная культура данного вида бактерий («конкретный образец данного вида) Колония – видимая глазом изолированная структура, образующаяся в результате размножения и накопления м/о за определенный срок инкубации и из одной родительской клетки или из нескольких идентичных клеток.
Вид - совокупность микроорганизмов, имеющих общее эволюционное происхождение, близкий генотип (высокую степень генетической гомологии, как правило более 60%) и максимально близкие фенотипические характеристики. Штамм – выделенная культура данного вида бактерий («конкретный образец данного вида) Колония – видимая глазом изолированная структура, образующаяся в результате размножения и накопления м/о за определенный срок инкубации и из одной родительской клетки или из нескольких идентичных клеток.
 Методы лабораторной диагностики Ø Микроскопический – обнаружение м/о непосредственно в клиническом материале Ø Бактериологический – выявление м/о путем посева материала на питательные среды Ø Биологический – выделение м/о из предварительно зараженного лабораторного животного Ø Серологический –выявление специфических иммунных антител в сыворотке крови больного Ø Аллергический –постановка кожно-аллергических проб (узко специфичен – туберкулез, туляремия и др.)
Методы лабораторной диагностики Ø Микроскопический – обнаружение м/о непосредственно в клиническом материале Ø Бактериологический – выявление м/о путем посева материала на питательные среды Ø Биологический – выделение м/о из предварительно зараженного лабораторного животного Ø Серологический –выявление специфических иммунных антител в сыворотке крови больного Ø Аллергический –постановка кожно-аллергических проб (узко специфичен – туберкулез, туляремия и др.)
 Ø Культуральные - характер роста микроорганизма на питательных средах. Ø Биохимические - способность ферментировать различные субстраты (углеводы, белки и аминокислоты и др.), образовывать в процессе жизнедеятельности различные биохимические продукты за счет активности различных ферментных систем и особенностей обмена веществ. Ø Антигенные - зависят преимущественно от химического состава и строения клеточной стенки, наличия жгутиков, капсулы, распознаются по способности макроорганизма (хозяина) вырабатывать антитела и другие формы иммунного ответа, выявляются в иммунологических реакциях.
Ø Культуральные - характер роста микроорганизма на питательных средах. Ø Биохимические - способность ферментировать различные субстраты (углеводы, белки и аминокислоты и др.), образовывать в процессе жизнедеятельности различные биохимические продукты за счет активности различных ферментных систем и особенностей обмена веществ. Ø Антигенные - зависят преимущественно от химического состава и строения клеточной стенки, наличия жгутиков, капсулы, распознаются по способности макроорганизма (хозяина) вырабатывать антитела и другие формы иммунного ответа, выявляются в иммунологических реакциях.
 Физиологические- способы углеводного (аутотрофы, гетеротрофы), азотного (аминоавтотрофы, аминогетеротрофы) и других видов питания, тип дыхания (аэробы, микроаэрофилы, факультативные анаэробы, строгие анаэробы). Ø Подвижность и типы движения. Ø Способность к спорообразованию, характер спор. Ø Чувствительность к бактериофагам, фаготипирование. Ø Химический состав клеточных стенок - основные сахара и аминокислоты, липидный и жинокислотный состав. Ø Белковый спектр (полипептидный профиль). Ø Ø Чувствительность к антибиотикам и другим лекарственным препаратам. Ø Генотипические (использование методов геносистематики).
Физиологические- способы углеводного (аутотрофы, гетеротрофы), азотного (аминоавтотрофы, аминогетеротрофы) и других видов питания, тип дыхания (аэробы, микроаэрофилы, факультативные анаэробы, строгие анаэробы). Ø Подвижность и типы движения. Ø Способность к спорообразованию, характер спор. Ø Чувствительность к бактериофагам, фаготипирование. Ø Химический состав клеточных стенок - основные сахара и аминокислоты, липидный и жинокислотный состав. Ø Белковый спектр (полипептидный профиль). Ø Ø Чувствительность к антибиотикам и другим лекарственным препаратам. Ø Генотипические (использование методов геносистематики).
 Бактериологический метод включает посев клинического материала на искусственные питательные среды, выделение чистых культур микробов и их последующую идентификацию.
Бактериологический метод включает посев клинического материала на искусственные питательные среды, выделение чистых культур микробов и их последующую идентификацию.
 Бактериологические методы используются: в диагностике инфекционных заболеваний; Ш При профилактических обследованиях на носительство бактерий кишечной группы, дифтерийной палочки и др. ; Ш при изучении санитарно-гигиенического состояния объектов внешней среды (вода, воздух, почва, продукты питания и др.) и исследовании их по эпидемиологическим показаниям на зараженность патогенными видами микроорганизмов. Ш
Бактериологические методы используются: в диагностике инфекционных заболеваний; Ш При профилактических обследованиях на носительство бактерий кишечной группы, дифтерийной палочки и др. ; Ш при изучении санитарно-гигиенического состояния объектов внешней среды (вода, воздух, почва, продукты питания и др.) и исследовании их по эпидемиологическим показаниям на зараженность патогенными видами микроорганизмов. Ш
 Физиологическая характеристика Отношение к температуре Дыхание Питание Ферменты Метаболизм белков и аминокислот (желатиназа, коллагеназа, декарбоксилазы, уреаза) Другие ферменты (гемолизины, липазы, лецитиназа, ДНКаза) Конечные продукты метаболизма (хроматография) Устойчивость/чувствительность к АМП
Физиологическая характеристика Отношение к температуре Дыхание Питание Ферменты Метаболизм белков и аминокислот (желатиназа, коллагеназа, декарбоксилазы, уреаза) Другие ферменты (гемолизины, липазы, лецитиназа, ДНКаза) Конечные продукты метаболизма (хроматография) Устойчивость/чувствительность к АМП



 Элементы, которые в первую очередь необходимы для роста микроорганизмов и должны включаться в состав питательной среды, определены из химического состава микробных клеток, который, в принципе, одинаков у всех живых организмов. Основная часть общей массы клеток представлена водой (80 – 90%) и только 10 – 20% приходится на сухое вещество. По количественному содержанию в сухом веществе выделяют макро- и микроэлементы. К числу первых относятся: углерод, кислород, азот, водород, сера, фосфор, калий, натрий, магний, кальций, железо. К микроэлементам –– марганец, молибден, цинк, медь, кобальт и др. , большинство из которых необходимо в следовых количествах. По этой причине в состав многих сред микроэлементы не добавляют, так как потребность в них может быть удовлетворена за счет примесей в солях макроэлементов. Кроме того, не все микроорганизмы нуждаются в микроэлементах. 14
Элементы, которые в первую очередь необходимы для роста микроорганизмов и должны включаться в состав питательной среды, определены из химического состава микробных клеток, который, в принципе, одинаков у всех живых организмов. Основная часть общей массы клеток представлена водой (80 – 90%) и только 10 – 20% приходится на сухое вещество. По количественному содержанию в сухом веществе выделяют макро- и микроэлементы. К числу первых относятся: углерод, кислород, азот, водород, сера, фосфор, калий, натрий, магний, кальций, железо. К микроэлементам –– марганец, молибден, цинк, медь, кобальт и др. , большинство из которых необходимо в следовых количествах. По этой причине в состав многих сред микроэлементы не добавляют, так как потребность в них может быть удовлетворена за счет примесей в солях макроэлементов. Кроме того, не все микроорганизмы нуждаются в микроэлементах. 14
 В отличие от животных и растительных организмов, микроорганизмы характеризуются разнообразием и типов питания, которые выделяют по трем основным критериям –– источник углерода, источник энергии и донор электронов (водорода). В зависимости от природы источника углерода все микроорганизмы разделены на 2 большие группы –– автотрофы, использующие углекислоту, и гетеротрофы, требующие для роста и размножения готовых органических веществ. С учетом разнообразия источников энергии и доноров электронов эти группы подразделены на подгруппы, в результате чего у микроорганизмов выделены 8 типов питания. Каждый тип питания характерен для определенных микроорганизмов и отражает их физиологобиохимические свойства. Большинство микроорганизмов, в том числе и патогенных, имеют тип питания, при котором источником углерода, энергии и донорами электронов являются органические вещества. 16
В отличие от животных и растительных организмов, микроорганизмы характеризуются разнообразием и типов питания, которые выделяют по трем основным критериям –– источник углерода, источник энергии и донор электронов (водорода). В зависимости от природы источника углерода все микроорганизмы разделены на 2 большие группы –– автотрофы, использующие углекислоту, и гетеротрофы, требующие для роста и размножения готовых органических веществ. С учетом разнообразия источников энергии и доноров электронов эти группы подразделены на подгруппы, в результате чего у микроорганизмов выделены 8 типов питания. Каждый тип питания характерен для определенных микроорганизмов и отражает их физиологобиохимические свойства. Большинство микроорганизмов, в том числе и патогенных, имеют тип питания, при котором источником углерода, энергии и донорами электронов являются органические вещества. 16
 Потребности микроорганизмов в органических источниках углерода весьма разнообразны. Некоторые виды являются ≪всеядными≫ и могут потреблять различные по химической природе вещества, другие отличаются большей избирательностью и используют лишь некоторые из них. Специфичность набора органических соединений, свойственного каждому виду микроорганизмов, учитывается при создании элективных и дифференциально-диагностических сред, широко применяемых в санитарной и клинической микробиологии для быстрой идентификации определенных групп микроорганизмов. При выборе углеродсодержащего субстрата необходимо учитывать, что усвояемость органических веществ в значительной степени зависит и от их свойств –– растворимости, степени окисленности атомов углерода, пространственной конфигурации и полимеризации их молекул. Обычно микроорганизмы усваивают определенные оптические изомеры –– сахара, относящиеся к D-ряду, аминокислоты –– к L-ряду. Очень мало микроорганизмов обладают ферментами, под действием которых один оптический изомер превращается в другой. Использовать такие биополимеры как крахмал, полисахариды, белки, жиры могут только те микроорганизмы, у которых синтезируются определенные гидролитические ферменты –– амилазы, протеазы, липазы в форме экзоферментов, т. е. ферментов, выделяемых клеткой в среду обитания. 17
Потребности микроорганизмов в органических источниках углерода весьма разнообразны. Некоторые виды являются ≪всеядными≫ и могут потреблять различные по химической природе вещества, другие отличаются большей избирательностью и используют лишь некоторые из них. Специфичность набора органических соединений, свойственного каждому виду микроорганизмов, учитывается при создании элективных и дифференциально-диагностических сред, широко применяемых в санитарной и клинической микробиологии для быстрой идентификации определенных групп микроорганизмов. При выборе углеродсодержащего субстрата необходимо учитывать, что усвояемость органических веществ в значительной степени зависит и от их свойств –– растворимости, степени окисленности атомов углерода, пространственной конфигурации и полимеризации их молекул. Обычно микроорганизмы усваивают определенные оптические изомеры –– сахара, относящиеся к D-ряду, аминокислоты –– к L-ряду. Очень мало микроорганизмов обладают ферментами, под действием которых один оптический изомер превращается в другой. Использовать такие биополимеры как крахмал, полисахариды, белки, жиры могут только те микроорганизмы, у которых синтезируются определенные гидролитические ферменты –– амилазы, протеазы, липазы в форме экзоферментов, т. е. ферментов, выделяемых клеткой в среду обитания. 17
 Для подавляющего большинства гетеротрофных микроорганизмов основными, легко доступными источниками углерода и энергии являются углеводы, аминокислоты, белки, органические кислоты. Характеризуя потребность микроорганизмов в органических источниках углерода следует отметить, что наибольшая степень гетеротрофности присуща патогенным микроорганизмам, приспособившимся к жизни в организме человека и животных. Состав питательных сред для их культивирования особенно сложен. Они содержат белки или продукты их неглубокого гидролиза (пептиды), витамины, фрагменты нуклеиновых кислот и др. Для приготовления таких сред используют различного типа гидролизаты и экстракты мяса, кровь или сыворотку, дрожжевые и растительные экстракты и многое другое. Эти среды пригодны для культивирования самых разных видов и особенно удобны в тех случаях, когда неизвестна потребность микроба в факторах роста или он нуждается во многих факторах роста одновременно. Недостатком таких сред является сложность или невозможность достижения их стандартности из-за нестандартности и ограниченной контролируемости состава и свойств исходного сырья. 18
Для подавляющего большинства гетеротрофных микроорганизмов основными, легко доступными источниками углерода и энергии являются углеводы, аминокислоты, белки, органические кислоты. Характеризуя потребность микроорганизмов в органических источниках углерода следует отметить, что наибольшая степень гетеротрофности присуща патогенным микроорганизмам, приспособившимся к жизни в организме человека и животных. Состав питательных сред для их культивирования особенно сложен. Они содержат белки или продукты их неглубокого гидролиза (пептиды), витамины, фрагменты нуклеиновых кислот и др. Для приготовления таких сред используют различного типа гидролизаты и экстракты мяса, кровь или сыворотку, дрожжевые и растительные экстракты и многое другое. Эти среды пригодны для культивирования самых разных видов и особенно удобны в тех случаях, когда неизвестна потребность микроба в факторах роста или он нуждается во многих факторах роста одновременно. Недостатком таких сред является сложность или невозможность достижения их стандартности из-за нестандартности и ограниченной контролируемости состава и свойств исходного сырья. 18
 Конструктивный метаболизм микроорганизмов в целом направлен на синтез четырех основных типов биополимеров –– белков, нуклеиновых кислот, полисахаридов и липидов. Для биосинтеза белков и нуклеиновых кислот важнейшим элементом, кроме углерода, является азот. Самым доступным источником азота для большинства микроорганизмов являются ионы аммония, которые они могут получать из солей органических и неорганических кислот, аминокислот, белков и других азотсодержащих веществ. Для многочисленной группы бактерий, главным образом патогенных, в качестве источников азота необходимы азотсодержащие органические вещества. Если таким источником азота являются аминокислоты, микроорганизмы могут их использовать непосредственно для синтеза белков, либо предварительно осуществить их дезаминирование, а выделившиеся при этом аминогруппы использовать для синтеза собственных аминокислот, белков. 19
Конструктивный метаболизм микроорганизмов в целом направлен на синтез четырех основных типов биополимеров –– белков, нуклеиновых кислот, полисахаридов и липидов. Для биосинтеза белков и нуклеиновых кислот важнейшим элементом, кроме углерода, является азот. Самым доступным источником азота для большинства микроорганизмов являются ионы аммония, которые они могут получать из солей органических и неорганических кислот, аминокислот, белков и других азотсодержащих веществ. Для многочисленной группы бактерий, главным образом патогенных, в качестве источников азота необходимы азотсодержащие органические вещества. Если таким источником азота являются аминокислоты, микроорганизмы могут их использовать непосредственно для синтеза белков, либо предварительно осуществить их дезаминирование, а выделившиеся при этом аминогруппы использовать для синтеза собственных аминокислот, белков. 19
 Однако, для роста некоторых микроорганизмов необходимы определенные аминокислоты, которые они не могут синтезировать сами. К числу микроорганизмов, нуждающихся в таких ≪незаменимых≫ аминокислотах, относятся золотистый стафилококк, гемолитический стрептококк, молочнокислые бактерии и некоторые другие. В зависимости от физиологических особенностей микробов, количество ≪незаменимых≫ аминокислот различно –– для золотистого стафилококка обязательно наличие в питательной среде лишь триптофана и цистина, а для гемолитического стрептококка –– 17 аминокислот. Белки, как источники азота, доступны только тем микроорганизмам, которые образуют протеолитические ферменты, выделяемые в среду (т. е. в экзоформе). Под действием этих ферментов белки расщепляются до более низкомолекулярных веществ –– пептонов и аминокислот. 20
Однако, для роста некоторых микроорганизмов необходимы определенные аминокислоты, которые они не могут синтезировать сами. К числу микроорганизмов, нуждающихся в таких ≪незаменимых≫ аминокислотах, относятся золотистый стафилококк, гемолитический стрептококк, молочнокислые бактерии и некоторые другие. В зависимости от физиологических особенностей микробов, количество ≪незаменимых≫ аминокислот различно –– для золотистого стафилококка обязательно наличие в питательной среде лишь триптофана и цистина, а для гемолитического стрептококка –– 17 аминокислот. Белки, как источники азота, доступны только тем микроорганизмам, которые образуют протеолитические ферменты, выделяемые в среду (т. е. в экзоформе). Под действием этих ферментов белки расщепляются до более низкомолекулярных веществ –– пептонов и аминокислот. 20
 Энергетический метаболизм микроорганизмов, как и конструктивный, характеризуется разнообразием биохимических механизмов. В этом метаболизме различают три основных типа ––аэробное дыхание, анаэробное дыхание и брожение, наиболее распространенным из которых является аэробное дыхание. В этом процессе органическое вещество окисляется до углекислоты и воды с максимальным выделением энергии, заключенной в этом веществе. Многие микроорганизмы с аэробным дыханием –– строгие аэробы, однако некоторые из них относятся к факультативным аэробам, поскольку они могут образовывать АТФ и в анаэробных условиях ––путем брожения. Некоторые микроорганизмы, главным образом бактерии, получают энергию в анаэробном дыхании, т. е. в результате окисления веществ, где в качестве акцепторов электронов выступает не кислород, а неорганические соединения. Так, отдельные виды рода Bacillus, E. coli осуществляют анаэробное дыхание, в процессе которого нитрат (NO 3) восстанавливается до аммиака; Clostridium aceticum окисляет молекулярный водород, используя в качестве акцептора электронов углекислоту. 21
Энергетический метаболизм микроорганизмов, как и конструктивный, характеризуется разнообразием биохимических механизмов. В этом метаболизме различают три основных типа ––аэробное дыхание, анаэробное дыхание и брожение, наиболее распространенным из которых является аэробное дыхание. В этом процессе органическое вещество окисляется до углекислоты и воды с максимальным выделением энергии, заключенной в этом веществе. Многие микроорганизмы с аэробным дыханием –– строгие аэробы, однако некоторые из них относятся к факультативным аэробам, поскольку они могут образовывать АТФ и в анаэробных условиях ––путем брожения. Некоторые микроорганизмы, главным образом бактерии, получают энергию в анаэробном дыхании, т. е. в результате окисления веществ, где в качестве акцепторов электронов выступает не кислород, а неорганические соединения. Так, отдельные виды рода Bacillus, E. coli осуществляют анаэробное дыхание, в процессе которого нитрат (NO 3) восстанавливается до аммиака; Clostridium aceticum окисляет молекулярный водород, используя в качестве акцептора электронов углекислоту. 21
 Простейшим по метаболизму типом энергетического метаболизма является брожение. Процессы брожения протекают в анаэробных условиях и сопровождаются выделением энергии. Основным субстратом брожения являются углеводы, однако бактерии могут сбраживать органические кислоты, в том числе и аминокислоты, а также пурины и пиримидины. Известно много типов брожения, каждый из которых вызывается особой группой микроорганизмов и в соответствии с механизмом сопровождается образованием специфических конечных продуктов. Конечными продуктами брожений обычно являются различные органические кислоты –– молочная, уксусная, янтарная, лимонная и др. , а также спирты (этиловый, бутиловый, пропиловый), углекислый газ и водород. По выходу основного конечного продукта выделяют и соответствующие типы брожения. В силу того, что при брожении не происходит полного окисления субстрата и в среду выделяются частично окисленные вещества, еще содержащие энергию –– органические кислоты, спирты и др. , общий выход АТФ в этом процессе на 1 моль сбраживаемого субстрата значительно (~ в 30 раз) ниже, чем при метаболизме того же субстрата в процессах дыхания. 22
Простейшим по метаболизму типом энергетического метаболизма является брожение. Процессы брожения протекают в анаэробных условиях и сопровождаются выделением энергии. Основным субстратом брожения являются углеводы, однако бактерии могут сбраживать органические кислоты, в том числе и аминокислоты, а также пурины и пиримидины. Известно много типов брожения, каждый из которых вызывается особой группой микроорганизмов и в соответствии с механизмом сопровождается образованием специфических конечных продуктов. Конечными продуктами брожений обычно являются различные органические кислоты –– молочная, уксусная, янтарная, лимонная и др. , а также спирты (этиловый, бутиловый, пропиловый), углекислый газ и водород. По выходу основного конечного продукта выделяют и соответствующие типы брожения. В силу того, что при брожении не происходит полного окисления субстрата и в среду выделяются частично окисленные вещества, еще содержащие энергию –– органические кислоты, спирты и др. , общий выход АТФ в этом процессе на 1 моль сбраживаемого субстрата значительно (~ в 30 раз) ниже, чем при метаболизме того же субстрата в процессах дыхания. 22


 Особая роль принадлежит Роберту Коху. Постулировав необходимость выделения чистой культуры микроба, он тем самым определил необходимость создания условий для решения этой задачи. Важнейшим из них явилась питательная среда, на которой можно было бы получить рост микроорганизма. С именем Коха связывают внедрение в микробиологическую практику в 1881 г. плотных питательных сред. Сама идея их использования возникла раньше и принадлежит немецкому исследователю Бредфельду. Более того, еще в 1877 г. Шретер культивировал бактерии на ломтях картофеля, что также может трактоваться как применение питательной среды. Заслуга Коха заключается в глубоком научном подходе к проблеме, широком использовании питательных сред в собственных исследованиях. Им же предложен первый отвердитель –– желатин, как компонент плотной среды. 25
Особая роль принадлежит Роберту Коху. Постулировав необходимость выделения чистой культуры микроба, он тем самым определил необходимость создания условий для решения этой задачи. Важнейшим из них явилась питательная среда, на которой можно было бы получить рост микроорганизма. С именем Коха связывают внедрение в микробиологическую практику в 1881 г. плотных питательных сред. Сама идея их использования возникла раньше и принадлежит немецкому исследователю Бредфельду. Более того, еще в 1877 г. Шретер культивировал бактерии на ломтях картофеля, что также может трактоваться как применение питательной среды. Заслуга Коха заключается в глубоком научном подходе к проблеме, широком использовании питательных сред в собственных исследованиях. Им же предложен первый отвердитель –– желатин, как компонент плотной среды. 25
 Привычный для современных микробиологов агар-агар был внедрен Фростом в повседневную практику значительно позже, в 1919 г. , хотя справедливо было бы вспомнить, что еще в 1881 г. Немецкая исследовательница Хессе предложила агар-агар. Более того, в 1913 г. русский микробиолог В. Л. Омелянский, отдавая должное питательным средам с желатином, отмечал, что агаризованные питательные среды предпочтительнее в тех случаях, когда микроб разжижает желатин. Идеи и практическая деятельность Коха получили в конце 19 и первой четверти 20 столетий интенсивное развитие. Именно в этот период исследователи ряда стран предложили питательные среды различного назначения, роль которых для практической микробиологии была и остается весьма значительной. Современный микробиолог каждый день в своей работе вспоминает их имена. В эти немногие годы японец по происхождению Ш. Эндо предложил свой агар для дифференциации энтеробактерий, австриец Э. Левенштейн –– среду для микобактерий, англичанин А. Мак. Конки –– селективную и дифференциально-диагностическую среду для кишечных микроорганизмов, немец Т. Китт и итальянец Д. Тароцци –– среду для облигатно анаэробных бактерий, француз Р. Сабуро, чех Ф. Чапек и американец А. Докс ––– среды для грибов, бразилец Р. Хоттингер –– среды широкого назначения на основе перевара мяса и т. д. 26
Привычный для современных микробиологов агар-агар был внедрен Фростом в повседневную практику значительно позже, в 1919 г. , хотя справедливо было бы вспомнить, что еще в 1881 г. Немецкая исследовательница Хессе предложила агар-агар. Более того, в 1913 г. русский микробиолог В. Л. Омелянский, отдавая должное питательным средам с желатином, отмечал, что агаризованные питательные среды предпочтительнее в тех случаях, когда микроб разжижает желатин. Идеи и практическая деятельность Коха получили в конце 19 и первой четверти 20 столетий интенсивное развитие. Именно в этот период исследователи ряда стран предложили питательные среды различного назначения, роль которых для практической микробиологии была и остается весьма значительной. Современный микробиолог каждый день в своей работе вспоминает их имена. В эти немногие годы японец по происхождению Ш. Эндо предложил свой агар для дифференциации энтеробактерий, австриец Э. Левенштейн –– среду для микобактерий, англичанин А. Мак. Конки –– селективную и дифференциально-диагностическую среду для кишечных микроорганизмов, немец Т. Китт и итальянец Д. Тароцци –– среду для облигатно анаэробных бактерий, француз Р. Сабуро, чех Ф. Чапек и американец А. Докс ––– среды для грибов, бразилец Р. Хоттингер –– среды широкого назначения на основе перевара мяса и т. д. 26


 Общие требования Содержание всех элементов для построения микробной клетки Достаточная влажность Обеспечение изотонии Определенная концентрация водородных ионов Окислительно-восстановительный потенциал Стерильность
Общие требования Содержание всех элементов для построения микробной клетки Достаточная влажность Обеспечение изотонии Определенная концентрация водородных ионов Окислительно-восстановительный потенциал Стерильность














 Основные фазы роста периодической культуры: начальная (лаг-) – 1, экспоненциальная (або логарифмическая) – 2 , стационарная - 3 отмирания – 4 (рис. 12) Рис. 12. Основные фазы роста микробной популяции на жидких питательных средах.
Основные фазы роста периодической культуры: начальная (лаг-) – 1, экспоненциальная (або логарифмическая) – 2 , стационарная - 3 отмирания – 4 (рис. 12) Рис. 12. Основные фазы роста микробной популяции на жидких питательных средах.


 Характер роста микроорганизмов на жидких питательных средах Ø Ø Ø Рост бактерий с равномерным помутнением среды, цвет которого не изменяется или изменяется в соответствии с цветом водорастворимого пигмента, образующегося в культуре микроба; Придонный рост бактерий – образование осадка (скудного или обильного, крошковидного, гомогенного, волокнистого и др.); Пристеночный рост с сохранением прозрачности питательной среды; Поверхностный рост бактерий – пленка на поверхности среды (тонкая, нежная, бесцветная или влажная, толстая хорошо видимая невооруженным глазом, плотная сухая со сморщенной, а иногда бородавчатой поверхностью); Цвет пленки, как и питательной среды, зависит от пигмента, вырабатываемого растущей культурой микроба.
Характер роста микроорганизмов на жидких питательных средах Ø Ø Ø Рост бактерий с равномерным помутнением среды, цвет которого не изменяется или изменяется в соответствии с цветом водорастворимого пигмента, образующегося в культуре микроба; Придонный рост бактерий – образование осадка (скудного или обильного, крошковидного, гомогенного, волокнистого и др.); Пристеночный рост с сохранением прозрачности питательной среды; Поверхностный рост бактерий – пленка на поверхности среды (тонкая, нежная, бесцветная или влажная, толстая хорошо видимая невооруженным глазом, плотная сухая со сморщенной, а иногда бородавчатой поверхностью); Цвет пленки, как и питательной среды, зависит от пигмента, вырабатываемого растущей культурой микроба.

 Характер роста микроорганизмов на полужидких питательных средах Исследуемая культура засевается в столбик 0, 2 – 0, 5% полужидкий агар. Определяется способность микроорганизма к движению – распространение от места посева (укола) в среду уколом в непосредственной близости от стенки пробирки.
Характер роста микроорганизмов на полужидких питательных средах Исследуемая культура засевается в столбик 0, 2 – 0, 5% полужидкий агар. Определяется способность микроорганизма к движению – распространение от места посева (укола) в среду уколом в непосредственной близости от стенки пробирки.
 Среда Эндо Дифференциально-диагностическая Состав: Основа – питательный агар Диф. фактор – лактоза Индикатор – основной фуксин, обесцвеченный сульфитом натрия Рост лактозо + колоний красного цвета с металлическим блеском
Среда Эндо Дифференциально-диагностическая Состав: Основа – питательный агар Диф. фактор – лактоза Индикатор – основной фуксин, обесцвеченный сульфитом натрия Рост лактозо + колоний красного цвета с металлическим блеском
 Среда Плоскирева Селективная, дифференциально-диагностическая Состав: Основа – питательный агар Элективный фактор – желчные соли, бриллиантовый зеленый, йод Диф. фактор – лактоза Индикатор – нейтральный красный Рост лактозо + колоний брусничного цвета
Среда Плоскирева Селективная, дифференциально-диагностическая Состав: Основа – питательный агар Элективный фактор – желчные соли, бриллиантовый зеленый, йод Диф. фактор – лактоза Индикатор – нейтральный красный Рост лактозо + колоний брусничного цвета
 Солевой агар Элективная среда Состав: Основа – питательный агар Элективный фактор – соль 10% Индикатор – нет Рост колоний, устойчивых к соли
Солевой агар Элективная среда Состав: Основа – питательный агар Элективный фактор – соль 10% Индикатор – нет Рост колоний, устойчивых к соли
 Желточно-солевой агар (Чистовича) Элективная, диагностическая Состав: Основа – питательный агар Элективный фактор – соль 10% Диф. фактор –желток яйца Индикатор – нет Рост колоний, устойчивых к соли, + помутнение вокруг колоний за счет лецитовителлазной активности
Желточно-солевой агар (Чистовича) Элективная, диагностическая Состав: Основа – питательный агар Элективный фактор – соль 10% Диф. фактор –желток яйца Индикатор – нет Рост колоний, устойчивых к соли, + помутнение вокруг колоний за счет лецитовителлазной активности
 Тетратионатная среда Мюллера-Кауфмана Среда предназначена для селективного обогащения при выявлении бактерий рода Salmonella Состав: Основа – питательный бульон Элективный фактор – соль селинистой кислоты Индикатор – нет Рост бактерий, устойчивых к селинисто-кислому натрию
Тетратионатная среда Мюллера-Кауфмана Среда предназначена для селективного обогащения при выявлении бактерий рода Salmonella Состав: Основа – питательный бульон Элективный фактор – соль селинистой кислоты Индикатор – нет Рост бактерий, устойчивых к селинисто-кислому натрию
 Солевой бульон Элективная среда Состав: Основа – питательный бульон Элективный фактор – 6. 5% Na. Cl Индикатор – нет Рост микроорганизмов, устойчивых к соли
Солевой бульон Элективная среда Состав: Основа – питательный бульон Элективный фактор – 6. 5% Na. Cl Индикатор – нет Рост микроорганизмов, устойчивых к соли

 Характер роста микроорганизмов на плотных питательных средах. Основные признаки: ü Размер – точечные (≤ 1 мм) – крупные (4 – 6 мм и более); ü Форма - правильная(круглая); неправильная (амебовидная), ризоидная; ü Контуры края – ровные или неровные(фестончатые, волнистые и др.) ü Рельеф колоний (куполообразные, плоско-выпуклые, колонии с вдавленным центром и др. ü Поверхность колонии (матовая или блестящая (S- R- формы); ü Цвет колонии (пигментообразование); ü Структура колонии (мелко- или грубо зернистые); ü Консистенция (вязкие, слизистые, пастообразные и др.
Характер роста микроорганизмов на плотных питательных средах. Основные признаки: ü Размер – точечные (≤ 1 мм) – крупные (4 – 6 мм и более); ü Форма - правильная(круглая); неправильная (амебовидная), ризоидная; ü Контуры края – ровные или неровные(фестончатые, волнистые и др.) ü Рельеф колоний (куполообразные, плоско-выпуклые, колонии с вдавленным центром и др. ü Поверхность колонии (матовая или блестящая (S- R- формы); ü Цвет колонии (пигментообразование); ü Структура колонии (мелко- или грубо зернистые); ü Консистенция (вязкие, слизистые, пастообразные и др.
 Пигментообразование бактерий Красно-коричневый (продигиозин) Serratia marcessens Желто-оранжевый, (каратиноиды) Рода Staphylococcus, Sarcina, M. tuberculosis Черный, бурый (меланин) B. cubtilis, Грибы рода Candida Синий (пиоцианин) P. aeruginosa Флюоресцирующий Желто-зеленый (пиовердин) Род Vibrio
Пигментообразование бактерий Красно-коричневый (продигиозин) Serratia marcessens Желто-оранжевый, (каратиноиды) Рода Staphylococcus, Sarcina, M. tuberculosis Черный, бурый (меланин) B. cubtilis, Грибы рода Candida Синий (пиоцианин) P. aeruginosa Флюоресцирующий Желто-зеленый (пиовердин) Род Vibrio

 Выделение чистых культур: посев на элективные среды Элективная среда Бэйд-Паркера для стафилококков. Рост микроорганизмов, устойчивых к теллуриту калия. Они превращают его в металлический теллур, и колония окрашивается в черный цвет
Выделение чистых культур: посев на элективные среды Элективная среда Бэйд-Паркера для стафилококков. Рост микроорганизмов, устойчивых к теллуриту калия. Они превращают его в металлический теллур, и колония окрашивается в черный цвет
 Выделение чистых культур: фильтрация через мембранные фильтры Микроорганизмы на фильтре Металлические обоймы для ядерных фильтров
Выделение чистых культур: фильтрация через мембранные фильтры Микроорганизмы на фильтре Металлические обоймы для ядерных фильтров

4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Бактериологическая диагностика брюшного тифа и паратифов
А, В и С
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН
Санкт-Петербургский НИИЭМ им. Пастера Роспотребнадзора
(Л.А.Кафтырева, З.Н.Матвеева, Г.Ф.Трифонова); ГОУВПО
"Санкт-Петербургская государственная медицинская академия им.
И.И.Мечникова" Федерального агентства по здравоохранению и
социальному развитию (А.Г.Бойцов).
3. УТВЕРЖДЕНЫ
Руководителем Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека, Главным государственным
санитарным врачом Российской Федерации Г.Г.Онищенко 29 декабря 2007
г. 0100/13745-07-34
4. ВВЕДЕНЫ В ДЕЙСТВИЕ с
момента утверждения.
5. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1. Область применения
1.1. В методических
рекомендациях изложены основные принципы и особенности
бактериологической диагностики брюшного тифа и паратифов А, В и С;
содержатся современные сведения о биологических свойствах
возбудителей, резистентности к антибактериальным препаратам, о
питательных средах для их выделения и особенностях дифференциации
возбудителей брюшного тифа и паратифов от других серологических
вариантов сальмонелл.
2. Список сокращений
АБП - антибактериальный
препарат
ВСА - висмут-сульфит
агар
ЛПУ -
лечебно-профилактическое учреждение
МПК - минимальная
подавляющая концентрация
П
- промежуточный
У
- устойчивый
Ч
- чувствительный
РИФ - реакция
иммунофлюоресценции
ЦНС - центральная нервная
система
В
таблицах:
"+" - положительная
реакция в первые сутки;
"-" - отрицательная
реакция на 4-20 сутки;
"(+)" - замедленная
положительная реакция на 2-20 сутки;
d
- различные ферментативные реакции.
Возможна дифференциация
на ферментативные варианты.
3. Общие положения
3.1. Брюшной тиф и
паратифы А, В и С являются антропонозными кишечными инфекциями,
вызываемыми микроорганизмами Salmonella Typhi, Salmonella Paratyphi
A, Salmonella Paratyphi В и Salmonella Paratyphi С. В настоящее
время чаще регистрируется брюшной тиф, реже - паратиф В, редко -
паратиф А и крайне редко - паратиф С.
3.2. Заболевания
характеризуются язвенным поражением лимфатической системы тонкой
кишки, бактериемией, лихорадкой, циклическим клиническим течением с
выраженной интоксикацией, розеолезной сыпью на кожных покровах
туловища, гепато- и спленомегалией. Более характерен запор, нежели
диарея. Изъязвление пейеровых бляшек подвздошной кишки примерно в
1% случаев приводит к кишечному кровотечению и прободению кишечника
с самыми неблагоприятными последствиями для больного.
3.3. Диагноз брюшного
тифа и паратифов А, В и С ставится на основании клинических
признаков болезни с учетом эпидемиологического анамнеза и данных
комплексного лабораторного обследования, которое включает
классические бактериологический и серологический методы.
Бактериологическая диагностика имеет приоритетное значение, т.к. в
этом случае удается получить наиболее полную информацию о
биологических свойствах возбудителя, включая его чувствительность к
антибактериальным препаратам.
3.4. Применение
антимикробных препаратов для этиотропной терапии брюшного тифа и
паратифов позволило, с одной стороны, снизить летальность с 10-20%
до уровня менее 1%, а с другой стороны - осложнило лабораторную
диагностику, т.к. нередко забор материала для лабораторного
исследования осуществляется уже после начала антибиотикотерапии.
Этот факт заставляет более тщательно подходить к вопросу выбора
материала для исследования, взятия исследуемого материала, техники
исследования.
3.5. Современной
особенностью эпидемиологии брюшного тифа является резкое увеличение
частоты завоза (заноса) инфекции с эндемичных по этому заболеванию
территорий, стран ближнего и дальнего зарубежья, а также заражение
жителей России при выезде в эти страны и в процессе миграции внутри
страны. Другой особенностью является наличие обширного контингента
высокого эпидемиологического риска в виде лиц без определенного
места жительства, среди которых регистрируется высокая
заболеваемость брюшным тифом.
3.6. Данные методические
рекомендации составлены с целью унификации методов
бактериологической диагностики брюшного тифа и паратифов А, В и С,
а также правильной интерпретации результатов лабораторного
исследования с учетом современных особенностей клиники, лечения и
эпидемиологической обстановки на конкретных территориях.
4. Показания к проведению бактериологической диагностики
Показанием к проведению
бактериологического исследования биологического материала на
наличие возбудителей брюшного тифа и паратифов А, В и С является
необходимость обследования:
4.1) больных с
подозрением на тифопаратифозное заболевание, а также с лихорадкой
неясной этиологии, продолжающейся 5 и более дней;
4.2) лиц, общавшихся с
больными брюшным тифом и паратифами А, В, С;
4.3) работников отдельных
профессий, производств и организаций при поступлении на работу и по
эпидемиологическим показаниям;
4.4) лиц перед
поступлением в стационары и специализированные санатории по
клиническим и эпидемиологическим показаниям;
4.5) лиц при оформлении
на стационарное лечение в больницы (отделения)
психоневрологического (психосоматического) профиля, дома
престарелых, интернаты для лиц с хроническими психическими
заболеваниями и поражениями ЦНС, в другие типы закрытых учреждений
с круглосуточным пребыванием;
4.6) больных брюшным
тифом и паратифами после исчезновения клинических симптомов
перенесенного заболевания перед выпиской из стационара;
4.7) лиц, переболевших
брюшным тифом и паратифами, во время диспансерного наблюдения;
4.8) хронических
бактерионосителей, выявленных среди работников отдельных профессий,
производств и организаций, при повторном поступлении на работу на
указанные предприятия и объекты;
4.9) секционного
материала при подозрении на заболевание брюшным тифом и
паратифами.
5. Материально-техническое обеспечение метода
5.1. Стандартное
испытательное и вспомогательное оборудование, средства измерения
для микробиологических лабораторий.
5.2. Питательные среды,
диагностические сыворотки и химические реагенты для
культивирования, выделения, идентификации и определения
чувствительности к антибактериальным препаратам возбудителей
брюшного тифа и паратифов А, В и С.
5.3. Для лабораторной
диагностики тифо-паратифозных заболеваний и выявления
бактерионосителей должны использоваться питательные среды и
реагенты, разрешенные к применению на территории Российской
Федерации в установленном порядке.
6. Лабораторная диагностика брюшного тифа и паратифов
6.1. Принцип
бактериологического метода основан на обнаружении живых
микроорганизмов в различных биологических субстратах (кровь, моча,
кал, желчь, костный мозг, розеолы) в зависимости от стадии
заболевания. Для этого производят посев определенного количества
биологического материала на специальные питательные среды с
последующей инкубацией в термостате и идентификацией выросших
колоний микроорганизмов, характерных для S. Typhi, S. Paratyphi A,
S. Paratyphi В и S. Paratyphi С, по культурально-ферментативным
свойствам и антигенной характеристике.
6.2. Только
бактериологическое исследование может обеспечить точную постановку
этиологического диагноза и контроль освобождения организма от
возбудителя. В отношении дифференциальной диагностики брюшного тифа
и паратифов единственным методом является лабораторное исследование
биологического материала с выделением возбудителя и идентификация
его до уровня серологического варианта, т.к. клиническое течение
инфекционного процесса не всегда позволяет различить эти
нозологические формы.
7. Бактериологическое исследование
7.1. Выделение
возбудителей брюшного тифа и паратифов А, В и С проводят по одной и
той же схеме бактериологического исследования биоматериалов.
7.2. Порядок сбора
материала для лабораторных исследований на тифо-паратифозные
заболевания определен СП
3.1.1.2137-06 .
7.3. Техника сбора и
транспортирования биоматериалов в микробиологические лаборатории
описана в МУ 4.2.2039-05 .
7.4. Материалом для
бактериологического исследования с целью диагностики брюшного тифа
и паратифов являются:
кровь;
испражнения;
моча;
Возбудители могут быть
также выделены из:
розеол;
костного мозга;
грудного молока.
Материалом для
бактериологического исследования с целью выявления
бактерионосителей, согласно СП
3.1.1.2137-06 , являются:
испражнения;
моча;
желчь (дуоденальное содержимое).
7.5. Исследование
секционного материала проводится с целью уточнения диагноза.
7.6. Сбор биологического
материала для лабораторных исследований осуществляется до начала
этиотропного лечения: медицинским работником, заподозрившим
тифо-паратифозную инфекцию; при групповой и вспышечной
заболеваемости - специалистами учреждений Роспотребнадзора и
персоналом лечебно-профилактических учреждений. От
госпитализируемых больных материал для бактериологического
исследования забирается в приемном отделении стационара.
7.7. От лиц, общавшихся с
больными или носителями (контактными), сбор материала проводится
медицинскими работниками ЛПУ и других организаций и учреждений по
месту выявления больных.
7.8. Биоматериал для
лабораторного исследования сопровождают специальным направлением.
Доставка материала самими обследуемыми не допускается. При
невозможности своевременной доставки материала используют
консерванты и транспортные среды (табл.1).
8. Бактериологическое исследование крови
Показанием к исследованию
крови является подозрение на тифо-паратифозные заболевания или
лихорадочное состояние невыясненного происхождения (лихорадка
неясного генеза), наблюдающееся в течение 5 и более дней (СП
3.1.1.2137-06).
Соотношение кровь -
питательная среда должно быть 1:10-1:60. Количество независимо
отбираемых проб крови и время их взятия определяется лечащим врачом
согласно МУ 4.2.2039-05 при
лихорадке неясного генеза или согласно МУ 04-723/3 МЗ СССР (1984)
при подозрении на тифо-паратифозные заболевания. У больных,
получающих антибактериальные препараты, пробы необходимо собирать
непосредственно перед введением (приемом) следующей дозы
препарата.
При наличии лихорадки
оптимальным является взятие крови на фоне повышения температуры
тела (но не на пике температуры!). Посев на питательные среды
проводят непосредственно у постели больного.
При подозрении на
тифо-паратифозные заболевания для посева крови можно использовать
среду Рапопорт, 20%-й желчный бульон, мясопептонный бульон с
добавлением 1%-й глюкозы (во флаконах по 100 мл). Ранее
использовали посев крови в стерильную дистиллированную
(водопроводную) воду. Однако предпочтительнее использовать
специальные среды для посева крови.
Количество засеваемой
крови в разгар лихорадки может составлять 10 мл, в более поздние
сроки - до 20 мл (у детей - до 5 мл).
При лихорадке неясного
генеза продолжительностью более 5 дней, как правило, должны
исследоваться несколько проб крови. Взятие крови из вены проводят
согласно МУ 4.2.2039-05 . Это
необходимо для дифференциации истинной бактериемии от случайной
контаминации крови при венопункции (вероятность загрязнения пробы
вследствие случайного прокола сальной или потовой железы составляет
3%). Для посева крови в этом случае используют две среды: 1) среду
для аэробов и факультативных анаэробов и 2) среду для облигатных
анаэробов (например, "двойная" среда + тиогликолевая среда согласно
приказу МЗ СССР от 12.04.85 N 535) или универсальную среду для
аэробов и анаэробов.
Предпочтительно
использовать промышленно произведенные среды, разрешенные к
применению в России.
Посевы инкубируют при 37
°С в течение 10 суток с ежедневным просмотром. При этом флаконы с
"двойной" средой наклоняют, омывая плотную часть среды.
При отсутствии признаков
роста на 10-й день выдается отрицательный ответ.
При наличии признаков
роста (помутнение, покраснение среды Рапопорт, появление видимых
колоний на плотной части "двойной" среды) проводят высев
параллельно на полиуглеводную среду и плотную среду в чашках Петри
(кровяной агар в случае лихорадки неясного генеза и среда Эндо при
подозрении на тифо-паратифозные заболевания).
Прямой высев на
полиуглеводные среды проводят для сокращения сроков исследования,
исходя из предположения, что при посеве крови с высокой
вероятностью будет наблюдаться рост монокультуры возбудителя. Для
контроля этого предположения и выделения чистой культуры путем
откола отдельных колоний необходим параллельный высев на среду Эндо
или кровяной агар.
Если на этих средах
наблюдается рост монокультуры, то можно учитывать биохимические
свойства по полиуглеводной среде. Для контроля чистоты культуры
необходимо провести микроскопию мазка с полиуглеводной среды,
окрашенного по Граму. На этом этапе возможна также постановка
реакции агглютинации на стекле с соответствующими агглютинирующими
О- и Н-сальмонеллезными сыворотками и выдача предварительного
ответа.
Схема бактериологического
исследования крови пациентов с подозрением на брюшной тиф и
паратифы представлена на рис.1.
Рис.1. Схема бактериологического исследования крови пациентов с подозрением на брюшной тиф и паратифы
Рис.1. Схема бактериологического исследования крови пациентов с подозрением на брюшной тиф и паратифы
Схема бактериологического
исследования крови пациентов при лихорадке неясного генеза
представлена на рис.2.
Рис.2. Схема бактериологического исследования крови пациентов с лихорадкой неясного генеза
Рис.2. Схема бактериологического исследования крови пациентов с лихорадкой неясного генеза
Ход дальнейшей
идентификации культуры по культурально-морфологическим,
ферментативным свойствам и серологической характеристике изложен
далее в соответствующих разделах.
9. Бактериологическое исследование испражнений
Пробы испражнений
отбирают сразу после дефекации из дезинфицированного и тщательно
вымытого судна, на дно которого был помещен лист плотной чистой
бумаги. Материал собирается с помощью ложки-шпателя,
вмонтированного в крышку стерильного контейнера. В отсутствие
контейнера со шпателем для отбора материала используют любой
стерильный инструмент (стерильный деревянный шпатель, проволочная
петля, ложечка и т.п.). При наличии патологических примесей
необходимо выбрать участки, содержащие слизь, гной, хлопья, но
свободные от крови. Образцы жидких испражнений отбирают с помощью
стерильной пластиковой пастеровской пипетки с замкнутым
резервуаром.
Объем забираемого
материала должен быть не менее 2 г. Оптимальным является взятие
материала в случае оформленного стула - в объеме грецкого ореха; в
случае жидкого стула его слой в контейнере должен быть не менее
1,5-2,0 см. Материал, помещенный в стерильный контейнер,
доставляется в лабораторию в течение 2 ч.
Если материал невозможно
доставить в лабораторию в течение 2 ч, его собирают в консервант
(транспортную систему со средой). Объем материала не должен
превышать объема среды.
Испражнения должны быть
тщательно гомогенизированы в среде. Образцы могут храниться до
начала исследования в течение суток в условиях холодильника (4-6
°С).
Транспортные среды и
консерванты, используемые для выделения возбудителей брюшного тифа
и паратифов А, В и С, а также других возбудителей острых кишечных
инфекций, представлены в табл.1.
Таблица 1
Транспортные среды и консерванты, наиболее часто используемые для транспортирования испражнений
|
Название
среды |
Обеспечивает сохранение |
|
среда
Кэрри-Блер |
всех кишечных патогенов, включая кампилобактерии |
|
среда
Эймс |
всех энтеробактерий |
|
среда
Стюарт |
сальмонелл и шигелл |
|
глицериновая
смесь |
всех
энтеробактерий, кроме иерсиний; предпочтительна для шигелл |
|
фосфатная
буферная смесь |
всех энтеробактерий |
|
боратно-буферный раствор |
всех энтеробактерий |
|
физиологический раствор |
всех энтеробактерий, включая кампилобактерии |
Пробы испражнений,
собранные непосредственно из прямой кишки с помощью ректального
тампона, используют преимущественно для объективизации диагноза
(МУ 4.2.2039-05). Взятие
материала осуществляется средним медицинским персоналом. Как
правило, специальный зонд для взятия мазка входит в состав
транспортной системы. Важно отметить, что попадание транспортных
сред на слизистую прямой кишки недопустимо! Поэтому ректальный
тампон должен погружаться в транспортную среду только после взятия
материала. Больного просят лечь на бок с притянутыми к животу
бедрами и ладонями развести ягодицы. Зонд-тампон вводят в задний
проход на глубину 4-5 см и, аккуратно вращая его вокруг оси,
собирают материал с крипт ануса. Осторожно извлекают зонд-тампон и
погружают его в транспортную среду. Транспортирование тампона без
среды не допускается.
В
лаборатории посев проб испражнений проводят непосредственно на
плотные дифференциально-диагностические питательные среды и
параллельно на среду обогащения.
Схема бактериологического
исследования испражнений представлена на рис.3.
Рис.3. Схема бактериологического исследования испражнений
Рис.3. Схема бактериологического исследования испражнений
Из нативных испражнений
готовят суспензию в 0,9%-м растворе хлорида натрия в соотношении
1:5-1:10, оставляют на 30 мин для оседания крупных частиц. После
этого одну каплю надосадочной жидкости засевают на чашки с плотными
питательными средами и 1 мл суспензии - в среду обогащения
(соотношение материал-среда должно быть 1:5).
Испражнения, доставленные
в лабораторию в консерванте (транспортной среде), перед посевом
должны быть тщательно гомогенизированы в среде, после чего проводят
прямой посев материала на плотные среды и среду обогащения в тех же
соотношениях, что и нативные испражнения.
Пробы испражнений,
собранные с помощью ректального тампона, исследуются аналогично
испражнениям, доставленным в консерванте. Следует помнить, что
ректальный тампон содержит меньшее количество микроорганизмов по
сравнению с нативными испражнениями, поэтому посевная доза должна
быть увеличена.
Максимальное выявление S.
Typhi, S. Paratyphi A, S. Paratyphi В и S. Paratyphi С в
испражнениях достигается при использовании сред обогащения, хотя у
больных в остром периоде заболевания возбудитель достаточно часто
выделяют и при прямом посеве. Посев на среды обогащения параллельно
с прямым высевом обязателен!
Все посевы инкубируют при
37 °С на дифференциально-диагностических средах 18-24 ч, на
висмут-сульфит агаре - 24-48 ч. Через 24 ч проводят высев со сред
обогащения на плотные среды (висмут-сульфит агар или среду Эндо).
Колонии, характерные для данных возбудителей, выросшие на плотных
средах, отсевают на полиуглеводную среду.
Необходимо отметить, что
техника распределения материала по поверхности чашки с плотными
средами должна обеспечить рост изолированных колоний типичного
вида, по которому можно визуально оценить культуральные свойства
микроорганизма.
Для выделения S. Typhi
предпочтительнее использовать висмут-сульфит агар (ВСА). Типичные
колонии S. Typhi имеют черный цвет и окружены черным или коричневым
ободком с металлическим блеском. Однако при обильном росте S. Typhi
часто не дает характерного почернения ВСА, поэтому чашки должны
быть засеяны так, чтобы обеспечить рост отдельных колоний.
Пробы фекалий можно
засевать на стандартные селективные среды для энтеробактерий,
разрешенные к применению на территории Российской Федерации. Тем не
менее, для выделения S. Турhi предпочтительнее всего использовать
висмут-сульфит агар. Ход дальнейшей идентификации культур по
ферментативным свойствам и серологической характеристике изложен
далее в соответствующих разделах.
10. Бактериологическое исследование мочи
Посев мочи производят для
диагностики с первых дней заболевания и вплоть до выписки больного,
а также с целью выявления бактерионосительства. Так как при тифе и
паратифах выделение возбудителя с мочой происходит периодически и
кратковременно, исследования мочи необходимо проводить повторно с
промежутками 5-7 дней.
Следует строго
придерживаться общих правил сбора мочи, изложенных в МУ 4.2.2039-05 . Вне зависимости от
способа получения мочи, она должна быть доставлена в лабораторию в
течение 2 ч. В крайнем случае допускается хранение мочи в течение
ночи в холодильнике.
Следует помнить, что в
зависимости от химического состава мочи бактерии в ней могут при
хранении как отмирать, так и размножаться.
Увеличение срока
сохранения материала может крайне затруднить интерпретацию
результата.
Производят прямой посев
мочи (или осадка после центрифугирования) без предварительного
обогащения согласно приказу МЗ СССР N 535 на плотные
дифференциально-диагностические среды, рекомендуемые для
сальмонелл, в том числе возбудителей брюшного тифа и паратифов.
Параллельно нативная моча засевается в среды обогащения двойной
концентрации в соотношении 1:1 или осадок мочи - в среды обычной
концентрации. Посевы помещают в термостат при 37 °С на 18-24 ч, а
затем со среды обогащения производят высев на плотные
дифференциально-диагностические среды. Колонии, выросшие на плотных
средах, идентифицируют по культурально-ферментативным и
серологическим свойствам.
11. Бактериологическое исследование желчи (дуоденального содержимого)
Желчь собирают в три
стерильные пробирки или стерильные одноразовые контейнеры раздельно
по порциям А, В, С согласно МУ
4.2.2039-05 и доставляют в лабораторию.
Проводят исследование
каждой порции (А, В, С) отдельно или готовят смесь из трех порций.
Пробы засевают:
на плотные дифференциально-диагностические
среды (ВСА, Эндо, ЭМС или др.) в количестве 0,5 мл;
в пробирку (флакон) с питательным бульоном
в соотношении 1:10. Нет необходимости засевать желчь на среды
обогащения, т.к. желчь сама является хорошей питательной средой для
возбудителей брюшного тифа и паратифов.
Засеянные среды вместе с
остатками желчи инкубируют при 37 °С.
Через 18-24 ч
просматривают посевы на плотных питательных средах (результаты
роста на ВСА учитывают через 24 и 48 ч) и делают пересев
подозрительных колоний на полиуглеводную среду.
Из питательного бульона
производят высевы на плотные дифференциально-диагностические
среды.
Из оставшейся желчи в
случае отрицательного результата прямого посева делают повторные
высевы на плотные дифференциально-диагностические среды через 18-24
ч и на 3, 5, 7 и 10 сутки.
Проводят идентификацию
выросших микроорганизмов по культурально-морфологическим,
ферментативным и серологическим свойствам.
12. Бактериологическое исследование материала из розеол
Бактериологическое
исследование ("соскоб" с розеол) проводят при наличии хорошо
выраженных розеол. Материал собирают асептически. Для этого участок
кожи над розеолами обрабатывают 70%-м этиловым спиртом, затем
протирают ватным тампоном, смоченным стерильным 0,9%-м раствором
хлористого натрия и осушают стерильным тампоном.
Материал для исследования
(тканевую жидкость) получают путем скарификации кожи над розеолой с
помощью скальпеля. На поврежденную кожу наносят 1-2 капли желчного
бульона или изотонического раствора хлорида натрия, смешивают с
выступившей тканевой жидкостью и собирают пастеровской пипеткой или
аналогичным одноразовым стерильным устройством в пробирку с одной
из жидких сред обогащения (желчный бульон, среда Рапопорт и др.). В
лаборатории посев выдерживают при 37 °С 18-24 ч с последующим
высевом на плотные дифференциально-диагностические среды (Эндо,
ЭМС, ВСА).
13. Бактериологическое исследование костного мозга
Хорошо известно, что при
лабораторном подтверждении диагноза "брюшной тиф" наиболее
результативным является бактериологическое исследование костного
мозга (высеваемость возбудителя составляет 90-95%). Даже у
пациентов с легкими и стертыми формами брюшного тифа, трудными для
клинического распознавания, а также на фоне приема антимикробных
препаратов, высеваемость миелокультур значительно выше, чем
гемокультур.
Однако на практике
бактериологическое исследование костного мозга проводится очень
редко, только по особым клиническим показаниям, при отсутствии
других лабораторных данных, подтверждающих диагноз брюшной тиф или
паратиф, т.к. эта инвазивная процедура достаточно травматична.
Забор материала для исследования проводят только в условиях
стационара при наличии соответствующего специалиста.
Материал для
бактериологического исследования (аспират) в количестве 0,50-0,75
мл получают асептически, путем проведения пункции грудины (рукоятки
или тела) и засевают в пробирку с одной из сред обогащения (желчный
бульон, среда Рапопорт и др.).
Если аспират невозможно
засеять в среду обогащения сразу после пункции, его собирают в
стерильную пробирку и немедленно направляют в лабораторию, где
производится посев в среду обогащения. В лаборатории посевы
инкубируют при 37 °С 18-24 ч с последующим высевом на плотные
дифференциально-диагностические среды.
Дальнейшее исследование
проводят, как при бактериологическом исследовании другого
биологического материала.
14. Питательные среды и реактивы
Перечень питательных сред
для выделения и идентификации возбудителей кишечных инфекций, в
частности энтеробактерий, обширен и неуклонно расширяется. Выбор
конкретных сред во многом обусловлен местными экономическими
условиями и традициями. Тем не менее, при этом следует
руководствоваться несколькими основными принципами.
14.1. В описании
питательной среды должно быть указано, что она может быть
использована не просто для выявления сальмонелл, а именно
Salmonella Typhi и S. Paratyphi А, В и С.
14.2. Следует отдавать
предпочтение сухим питательным средам известных производителей по
сравнению со средами, непосредственно изготовляемыми в
лаборатории.
14.3. Каждая партия
питательной среды в лаборатории должна контролироваться с помощью
тест-штаммов (внутренний контроль качества).
14.4. Для лабораторной
диагностики тифо-паратифозных заболеваний и выявления
бактерионосителей должны использоваться питательные среды и
реагенты, разрешенные к применению на территории Российской
Федерации в установленном порядке.
15. Методы изучения ферментативных свойств
В
настоящее время для изучения ферментативной активности
микроорганизмов семейства Enterobacteriaceae, включая возбудителей
брюшного тифа и паратифов, разработаны, выпускаются и
зарегистрированы различные диагностические тест-системы
отечественного и зарубежного производства (от наиболее простых
классических сред Гисса в пробирках и планшетах до автоматических
анализаторов). Если тест-системы позволяют идентифицировать
микроорганизм до уровня рода и выявлять особенности ферментативной
активности штаммов, то они могут быть использованы для
идентификации возбудителей брюшного тифа и паратифов. Методика
работы с тест-системами подробно изложена в инструкциях по
применению и их следует строго соблюдать.
16. Биологические свойства возбудителей
Возбудители брюшного тифа
и паратифов А, В и С относятся к семейству Enterobacteriaceae, роду
Salmonella, виду enterica, подвиду I (enterica) и обладают
морфологическими, культуральными и ферментативными свойствами,
характерными для данного подвида, вида, рода и семейства.
У
представителей рода сальмонелл вида enterica исторически сложилась
ситуация, когда для обозначения сероваров использовали не
антигенную формулу, как у других бактерий, а названия болезней
(человека или животных), страны, города или улицы, где они были
выделены, и др. Ошибочно считать эти названия видовыми, т.к. они не
имеют таксономического статуса. Тем не менее, названия наиболее
часто встречающихся сероваров сальмонелл настолько привычны, что
заменить их антигенными формулами практически нереально. Поэтому в
современной схеме Кауфмана-Уайта при обозначении сальмонелл только
вида enterica подвида I вместо видового обозначения используют
название серовара, но пишут его с заглавной буквы.
Таким образом, полные
названия возбудителей брюшного тифа и паратифов следующие:
Salmonella enterica subsp. enterica serovar
Typhi;
Salmonella enterica subsp. enterica serovar
Paratyphi A;
Salmonella enterica subsp. enterica serovar
Paratyphi B;
Salmonella enterica subsp. enterica serovar
Paratyphi С
В
обычной практике возможно использование сокращенных вариантов
названий:
Salmonella ser. Typhi или Salmonella Typhi
или S. Typhi;
Salmonella ser. Paratyphi А или Salmonella
Paratyphi А или S. Paratyphi A;
Salmonella ser. Paratyphi В или Salmonella
Paratyphi В или S. Paratyphi B;
Salmonella ser. Paratyphi С или Salmonella
Paratyphi С или S. Paratyphi С
16.1. Культурально-морфологические свойства
Подвижные
грамотрицательные палочки не образуют спор и капсул, факультативные
анаэробы хорошо растут на обычных питательных средах.
На простом питательном
агаре - слегка выпуклые с ровным краем и гладкой поверхностью,
влажные с блеском колонии более 1 мм.
На
дифференциально-диагностических средах (содержащих лактозу как
дифференцирующее вещество) - прозрачные, бесцветные или
голубоватые, а иногда розоватые или цвета среды колонии (среды
Эндо, Плоскирева, ЭМС и другие аналогичные среды).
На SS-arape - колонии
цвета среды с черным центром.
На висмут-сульфитной
среде - изолированные колонии S. Typhi, S. Paratyphi В - черные с
характерным металлическим блеском, среда под колонией прокрашена в
черный цвет. Колонии S. Paratyphi A - зеленоватые, светлые в цвет
среды, нежные.
Штаммы S. Paratyphi В
(возбудитель паратифа В) на мясопептонном агаре могут образовывать
по периферии колоний приподнятый слизистый вал. Слизистый вал
развивается на 2-5 сутки при хранении посевов при комнатной
температуре. Этот признак не является постоянным и
диагностическим.
16.2. Ферментативные свойства
Изучение ферментативных
свойств проводится в отношении набора углеводов, многоатомных
спиртов, аминокислот и других органических соединений, применяемых
при идентификации и изучении сальмонелл и других энтеробактерий.
Как правило, в практических лабораториях используют небольшое
количество тестов, позволяющих идентифицировать основные роды,
входящие в семейство кишечных бактерий. Характеристика
ферментативных свойств сальмонелл, включая возбудителей брюшного
тифа и паратифов А, В и С, представлена в табл.2.
Таблица 2
Ферментативные свойства возбудителей брюшного тифа и паратифов А, В, С
|
Субстрат |
S. Paratyphi
A |
||||
|
Глюкоза
(газ) |