Лактобактерии в кишечнике если не хватает. Бактериальный вагиноз — проблема, о которой должна помнить каждая женщина
Взаимодействие между микроорганизмом в слизистом слое кишечника и человеком характеризуется активным влиянием обоих партнеров. Успешное существование бактерий заключается в постоянном их движении через слизистый слой и ведет к колонизации слизистой оболочки микроорганизмами. Микроэкологическая система организма как взрослого, так и ребенка — очень сложный филогенетический комплекс, который включает разнообразные по количественному и качественному составу ассоциированные микроорганизмы. Из огромного числа микроорганизмов, непрерывно попадающих в пищеварительный тракт человека, только определенные виды в процессе длительной эволюции закрепились в кишечнике и составили его облигатную флору, выполняющую важные для организма физиологические функции .
Они обнаружили большее микробное разнообразие в кишечнике африканских детей. Аналогичные результаты показывают исследования по «фермерским детям». Вреден для микробиома. Средства защиты убивают не только патогены, но и полезные кишечные бактерии. После однократного лечения кишечная флора регулирует - как правило, частые антибактериальные терапии, однако они могут постоянно меняться. «Особенно в первые несколько лет, когда развивается микробиома, вы должны давать только антибиотики, если они действительно необходимы», - советует педиатр Колетско.
Нормальная микробная флора желудочно-кишечного тракта (ЖКТ) насчитывает 500 видов. В толстой кишке человека имеется около 1,5 кг микроорганизмов, а в 1 г фекалий — до 250 млрд. В сутки человек выделяет с испражнениями более 17 трлн микробов.
В начале ХХ века на значение микробной флоры для здорового человека впервые обратил внимание И.И. Мечников, который предположил, что причиной многих болезней являются различные метаболиты и токсины, продуцируемые микроорганизмами, заселяющими различные органы и системы организма человека. И.И. Мечников был настолько увлечен своей теорией, что искренне считал толстый кишечник вместилищем патогенной, вредной микрофлоры, «ошибкой природы» и придерживался мнения о необходимости удалять его при рождении. И.П. Павлов, несмотря на то, что глубоко уважал И.И. Мечникова, горячо спорил с ним и критиковал его точку зрения по этому вопросу.
Увеличивает ли кишечная флора ожирение?
Исследования показывают взаимосвязь между микробиомом и ожирением. Затем он пересаживал кишечные бактерии от тучных мышей на тонких животных - и они быстро увеличивались, хотя они и перестали есть. Бактерии могут помочь сделать человека избыточным весом, - говорит Халлер. «Но это не главная причина - вы толстеете, потому что потребляете больше калорий, чем потребляете, - не из-за кишечной флоры».
Важно: диета меняет состав микробиома. «Будем ли мы есть много или мало мяса, много или немного волокон влияет на наши бактерии», - говорит Халлер. И какова диета для здорового микробиома? Экспертов нельзя убедить дать конкретные советы. Мы все еще слишком мало знаем о нашей микро-биоме, - говорит Халлер.
В настоящее время состояние динамического равновесия между организмом хозяина, микроорганизмами, его заселяющими, и окружающей средой, при котором здоровье человека находится на оптимальном уровне, принято называть эубиозом.
Существует множество причин, по которым происходит изменение соотношения нормальной микрофлоры пищеварительного тракта. Например, состав микробной популяции, заселяющей организм, зависит от питания, образа жизни, климата, приема лекарственных препаратов (особенно антибиотиков), состояния стресса, географических факторов, возрастных периодов и др. Изменения этого состава могут быть как кратковременными (дисбактериальные реакции), так и стойкими (дисбактериоз) .
Так работают микробы в толстой кишке
Пищеварение: собственные бактерии организма расщепляют остатки пищи и обеспечивают питательные вещества клеткам слизистой оболочки кишечника. Во внутриутробной жизни кишечный тракт является стерильным, и он после рождения, когда развивается кишечная флора. В первые дни жизни бифидобактерии колонизируют кишечник, защищающий ребенка от инфекций. Основные из кишечной флоры - ограничить рост потенциально патогенных микроорганизмов в кишечнике и взаимодействовать с непоглощенными субстратами диеты. Однако кишечная флора уязвима для определенных условий.
Самое большее внимание как потенциальное лечебное средство привлекают лактобациллы. Именно их целебные свойства оказались наиболее хорошо изученными и научно обоснованными. В 1920-30-е гг. культура Lactobacillus acidophilus стала использоваться в форме ацидофильного молока для лечения заболеваний желудочно-кишечного тракта, сопровождающихся запорами. Создание же таблетированных форм живых бактерий в то время оказалось безуспешным, в связи с чем интерес к применению микробных препаратов в лечебных целях несколько угас .
У взрослых он значительно варьируется, поскольку они зависят от нескольких факторов, таких как гены, окружающая среда, антибиотики, лекарства, инфекции, возраст, хирургические вмешательства в желудке или кишечнике, в печени, почках, раке. Наличие стабильной и сбалансированной флоры является хорошей гарантией, поскольку предотвращает колонизацию и развитие патогенных микроорганизмов с помощью различных механизмов, таких как бактериоцины и бактериофаги. Неравновесие флоры можно предотвратить с помощью живых микробных культур, эти культуры называются пробиотиками.
Бактерии семейства Lactobacillus — непатогенные грамположительные неспорообразующие облигатные или факультативные анаэробы с высокой ферментативной активностью. Они являются облигатной флорой с выраженным полиморфизмом. Среда их существования — разные отделы желудочно-кишечного тракта, начиная с ротовой полости и заканчивая толстым кишечником, где они поддерживают уровень рН 5,5-5,6. Хотя лактобактерии (ЛБ) составляют меньшую часть флоры кишечника, их метаболические функции делают особенно значимой эту популяцию. У новорожденного ребенка 2,4 % нормальной флоры кишечника составляют лактобактерии, а патогенных организмов не содержится . В кишечнике обитают следующие виды лактобацилл: Lactobacillus acidophilus, L.casei, L.bulgaricus, L.plantarum, L.salivarius, L.rhamnosus, L.reuteri .
Но Мечников так же известен другим своим открытиям: он работал в Бактериологическом институте Одессы и Институте Пастера, который был его директором, а последнее десятилетие его жизни зафиксировано в том, что в Болгарии существовал невероятный число жителей столетнего возраста, несмотря на то, что оно является одной из беднейших европейских стран. Причиной этого необычайного долголетия не могло быть и его докторов. Но было очевидно, что болгары потребляли большое количество йогурта, в котором содержатся молочные ферментеры.
Мечникову удалось выделить бактерии, ответственные за йогурт, и использовать его для него. Это было официальное начало пробиотиков. Функциональные продукты, приготовленные с помощью пробиотиков, должны содержать не менее 10 миллионов жизнеспособных клеток на 100 мл, идеальную дозу для достижения желаемых эффектов и увеличения естественной защиты, однако доза будет зависеть от используемого микроорганизма, способа потребления и желаемый эффект.
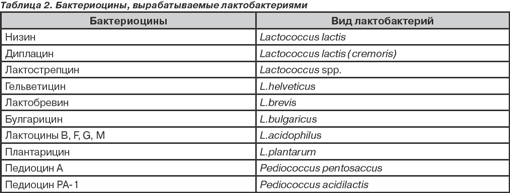
Молочнокислые бактерии веками использовались человеком для получения различных пищевых продуктов. Лактобактерии в процессе жизнедеятельности вступают в сложные взаимоотношения с другими микроорганизмами, в результате чего угнетаются гнилостные микроорганизмы и пиогенные условно-патогенные организмы, возбудители острых кишечных инфекций за счет способности образовывать целый ряд таких веществ, как молочная кислота, лизоцим, лактоцины B, F, J, M, лактоцидин и ацидолин, обладающих антибактериальным эффектом (табл. 1).
Как сказал Эли Метчников: «Если ожидаемые и предполагаемые эффекты не появятся, по крайней мере, он будет удовлетворен хорошим вкусом». Чтобы пробиотик был идеальным, он должен пережить желудочно-кишечный тракт. Прибытие интактного в кишечник подается там, для чего необходимо, чтобы прилипание к эпителию колонизировалось и таким образом увеличивало кислотность, которая препятствует развитию бактерий, вызывающих болезнь и, прежде всего, должна быть безобидной. В большинстве случаев пробиотики представляют собой молочнокислые бактерии, которые составляют важный процент местной флоры кишечника человека.
Бактериоцины, вырабатываемые лактобактериями, представлены в табл. 2.
Доказано, что лактобактерии как in vitro, так и in vivo подавляют размножение Klebsiella pneumoniae, Proteus vulgaris, Pseudomonas aeruginosa, P.flourescens, Salmonella typhosa, S.schottmuelleri, Sarcina lutea, Shigella dysenteriae, S.paradysenteriae, Serratia marcescens, Staphylococcus aureus, Str.faecalis, S.lactis, Vibrio comma . В то же время молочнокислые бактерии необходимы для жизнедеятельности не менее важной популяции бифидобактерий. В экспериментах на крысах замечено, что при удалении лактобактерий или недостатке их в кишечнике рано или поздно происходило значимое снижение количества бифидобактерий .
Чтобы правильно выбрать пробиотическое дополнение, оно должно быть, препараты «сублимационной сушки» более стабильны и сохраняют свои свойства дольше. Желательно проверить срок годности, потому что, если они хранятся в течение длительного времени, они могут потерять свои положительные эффекты.
Он также рекомендуется женщинам с вагинальными инфекциями. Эти пробиотические бактерии развиваются очень хорошо в молочной среде. Первым из этих специальных молочных продуктов является материнство: исследования, проведенные у младенцев, кормящихся грудным молоком, показали, что в кишечнике этих детей есть бактерии, которые делают их менее восприимчивыми к инфекциям, чем детям, кормящим другим молоком. Поэтому другой из пробиотических опций, найденных в гондолах, - это ферментированное молоко, добавленное бактериями.
Опубликовано довольно много работ, посвященных профилактике и лечению антибиотикоассоциированной диареи (ААД) у взрослых и детей. В 2002 г. в Британском медицинском журнале опубликованы материалы метаанализа 4 исследований эффективности лактобактерий в профилактике ААД. В группе вмешательства по сравнению с группой плацебо частота диареи достоверно уменьшилась на 66 %. Частота диареи в группе приема лактобактерий составила 3,7 против 26 % в группе плацебо .
Все эти молочные порошки поражают патогенные микроорганизмы, регулируют баланс кишечника, облегчают усвоение пищи, увеличивают лактозу, улучшают иммунитет органов пищеварения и дыхания и способствуют поглощению кальция. Короче говоря, преимущества, которые намного перевешивают питательные преимущества обычных молочных продуктов.
Следует учитывать, что они являются живыми организмами и теоретически могут быть ответственны за неблагоприятные последствия, такие как инфекции и нарушения обмена веществ. Использование пробиотиков и пребиотиков в педиатрии. Университетская больница общего профиля Грегорио Мараньон. В нормальных условиях различные поверхности организма колонизируются большим количеством микробных клеток. Внутри этих поверхностей кишечник является наиболее интенсивно колонизированной зоной и представляет собой высокодинамичную экосистему.
Уже в XXI веке появились работы об антагонизме лактобактерий и пилорического хеликобактера . Проведенные затем пока еще немногочисленные клинические исследования показали, что частота эрадикации при стандартной антихеликобактерной терапии в случае одновременного приема препарта лактобактерий возрастала на 23 % .
Молочнокислые бактерии играют роль в защите против возбудителей бактериального вагиноза. Они используют гликоген влагалищных эпителиальных клеток для производства молочной кислоты, что помогает поддерживать рН этой среды на уровне между 4,0 и 4,5 и создает неблагоприятную среду для роста патогенных организмов, таких как Candida albicans, Trichomonas vaginalis и некоторых других неспецифических бактерий, вызывающих влагалищные инфекции.
Микробиота кишечника играет ключевую роль в здоровье людей с такими функциями, как защита от колонизации патогенных микробов, регулирование кишечного транзита, конъюгирование желчных кислот и стимулирование энтерогептической циркуляции, ферментация непереваренных углеводов, производство витаминов и факторов роста и, наконец, созревания иммунной системы.
В настоящее время большое значение придается модуляции этой кишечной микробиоты через функциональные продукты, которые являются полезными для здоровья для здоровой питательной функции. Некоторые из этих продуктов содержат пробиотики, пребиотики и симбиотики как составные части, ассоциацию двух предыдущих.
Лактобактерии играют важную роль в иммуномодуляции, в том числе стимулируют фагоцитарную активность нейтрофилов, макрофагов, синтез иммуноглобулинов и участвуют в образовании интерферонов. Так, исследования , в которых сравнивали эффекты препаратов, содержащих живые и убитые ЛБ, показали, что и живые, и убитые ЛБ стимулировали фагоцитарную активность лейкоцитов мышей. Продемонстрировано также, что включение в рацион здоровых животных L.acidophilus (HN017), L.rhamnosus (HN001) вызывало повышение фагоцитарной активности лейкоцитов крови и перитонеальных макрофагов по сравнению с контролем, а также увеличение продукции интерферона-g спленоцитами .
Номенклатура рассматривает род, виды и штамм. Пребиотики - это в основном углеводы, которые не могут быть перевариты тонкой кишкой и ферментированы микробиотой толстой кишки. Таким образом, они способствуют распространению кишечных бактерий, таких как бифидобактерии и лактобактерии. В Европе основными пребиотиками, используемыми в пище, являются фруктоолигосахариды и инулин. Инулин содержится в таких продуктах, как пшеница, лук, чеснок, лук-порей и подорожник.
Клинические применения пробиотиков и пребиотиков. Пробиотики использовались при большом числе педиатрических патологий, главным образом в желудочно-кишечных проблемах с изменением микробиоты кишечника, таких как инфекционная диарея, бактериальный перерождение, некротизирующий энтероколит и, в последнее время, при хронических воспалительных процессах, таких как воспалительное заболевание кишечника, или в функциональные расстройства, такие как детское колики или запоры. Кроме того, в детстве есть несколько линий исследований в области пробиотических и пребиотических добавок.
Недавно было показано, что бактерии рода Lactobacillus способны активировать клеточный иммунитет и подавлять продукцию IgE. Так, штамм Lactobacillus casei Shirоta обладал свойством изменять фенотип Т-хелперов (Th) от неонатально предоминированных Тh2, участвующих в реакциях гуморального иммунитета, на Thl, участвующих в клеточном иммунитете .
Большое разнообразие в дизайне исследований оправдывало большую изменчивость результатов эффективности. Фактически, большинство метаанализов по этим исследованиям заключают, что в определенных группах пациентов недостаточно лечения с конкретными пробиотиками, чтобы иметь возможность устанавливать окончательные руководящие принципы лечения. Следует учитывать, что разные пробиотики используют разные стратегии действия и что не все пробиотические штаммы имеют одинаковую резистентность или способность к колонизации и, следовательно, не имеют такой же клинической эффективности.
Показано, что у мышей введение лактобактерий внутрь сопровождалось увеличением количества плазматических клеток, усилением синтеза антител к вирусу гриппа и ротавирусу , а также увеличением синтеза IgA и IgM на слизистых оболочках бронхов .
Кроме того, в последние годы появились экспериментальные работы, свидетельствующие о способности пробиотиков направленно активировать NK-лимфоциты. Так, выявлено, что при инкубации лактобактерий с моноцитами человека маркеры активации CD69 и CD25 определялись только на NK-лимфоцитах. Наиболее выраженный эффект оказывала культура L.johnsonii . Также доказано, что введение L.casei (штамм Shirota ) интраназально и внутрь мышам стимулирует функциональную активность NK-лимфоцитов периферической крови и органов дыхания . В некоторых исследованиях доказано, что иммуностимулирующий эффект пробиотиков зависит от дозы бактерий.
Поэтому мы должны учитывать, что эффекты в клинической практике специфичны для штаммов и не указаны для одних и тех же ситуаций. Сгруппированные данные разных штаммов могут приводить к ложным выводам. Использование пробиотиков должно быть сосредоточено на сопоставлении штаммов и доз продукта, используемого в ситуации, для которой оно показало пользу в клинических испытаниях.
Наибольшее доказательство эффективности пробиотиков было описано при лечении острой инфекционной диареи. К числу задействованных механизмов относятся стимуляция иммунной системы, конкуренция за места адгезии в кишечных клетках и развитие нейтрализующих веществ патогенных микроорганизмов. Различные систематические обзоры, проведенные в исследованиях, опубликованных с разными штаммами, заключают, несмотря на их большую изменчивость, что пробиотики оказывают благотворное влияние на развитие острой инфекционной диареи.
Доказано, что добавление в культуру лимфоцитов L.рaracasei (NCC2461) угнетало пролиферацию CD4+-лимфоцитов, что сопровождалось увеличением уровня противовоспалительных цитокинов: ИЛ-10 и трансформирующего фактора роста β (ТФР-β) .
Многие авторы подтверждают защитное действие ЛБ в отношении кишечных инфекций и опухолей . L.casei, L.acidophilus, L.rhamnosus, L.bulgaricus, L.lactis и L.plantarum способны взаимодействовать с клетками пейеровых бляшек и вызывают повышение концентрации плазматических клеток, CD4+-клеток и антител, специфичных к этим бактериям. Увеличение уровня CD8+-лимфоцитов в lamina propria слизистой оболочки кишечника наблюдалось только при введении L.plantarum .
Благотворный эффект пробиотиков более значим при поносах, вырабатываемых ротавирусом, хотя есть также преимущества в тех, которые вызваны другими вирусами. Имеются очень ограниченные доказательства его эффективности в лечении стойкой диареи у детей. Благоприятные эффекты были более заметны, когда пробиотики вводились ранее в ходе заболевания, и никаких побочных эффектов при их введении не наблюдалось.
Исходя из вышеприведенных данных, некоторые из текущих рекомендаций или рекомендаций по лечению острого гастроэнтерита включают использование пробиотиков доказанной эффективности и при адекватных дозах. До сих пор очень мало исследований, которые заключают, что использование пробиотиков значительно снижает частоту диареи, приобретенной в сообществе.
Отмечено снижение артериального давления у больных с артериальной гипертензией на фоне приема L.casei, L.helveticus : гипотензивным действием обладает субстанция SG-I (полисахаридно-пептидный комплекс бактериального происхождения).
19 декабря 2006 г. в онлайновой публикации Nature Medicine показано, что пероральный прием штамма Lactobacillus acidophilus индуцирует экспрессию μ-опиоидных рецепторов и каннабиноидных рецепторов 2 в клетках кишечного эпителия, опосредующих анальгезирующие эффекты в кишечнике, что вносит свой вклад в модуляцию и восстановление нормальной перцепции висцеральной боли.
Диарея, связанная с антибиотиками. Исследования, проведенные, в основном, у взрослых, показали, что прием пробиотиков в сочетании с антибиотиками снижает риск развития диареи, связанной с ними. Его администрация должна проводиться в начале лечения, а не когда таблица развязана там, где она больше не полезна.
Воспалительное заболевание кишечника. Использование пробиотиков при воспалительных заболеваниях кишечника, с физиопатологической точки зрения, является хорошей терапевтической альтернативой. Однако, хотя данные исследований показывают, что это будет иметь благоприятные последствия, было бы желательно иметь возможность проводить более контролируемые исследования с большим количеством пациентов, чтобы применять положительные эффекты, которые они оказывают на кишечную флору, и которые положительно повлияют на болезнь Было показано, что некоторые пробиотические препараты эффективны при язвенном колите и поухите.
Лактобактерии активно участвуют в процессах протеолиза. При этом протеин превращается в легко усваиваемые компоненты (рис. 1). Это свойство является особенно важным для новорожденных, во время питания в период выздоровления. Не менее важной функцией является участие в липолизе. При этом комплексные жиры превращаются в легко усваиваемые компоненты (рис. 2).

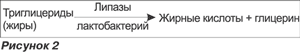
Это свойство является полезным для приготовления диетических препаратов для новорожденных, которые используются в период выздоровления.
По результатам доклинических и клинических исследований установлено, что молочнокислые бактерии могут расщепить холестерин в липидах сыворотки. Они также способствуют снижению холестеринемии благодаря блокировке гидроксиметил-глутарат-СоА-редуктазы — фермента, ограничивающего скорость синтеза холестерина (рис. 3).
![]()
Лактобациллы имеют ферменты β-галактозидазы, гликолазы и молочные дегидрогеназы, что делает возможным их участие в метаболизме лактозы. Это имеет особенно важное значение у детей с врожденной лактозной недостаточностью, а также развивающейся после перенесенных кишечных инфекций или курсов антибиотикотерапии.
После осуществления проверки разных типов молочнокислых бактерий было установлено, что некоторые лактобактерии образуют левовращающую D(-) форму молочной кислоты, которая не является эффективным антагонистом и может повлечь метаболические нарушения. ВОЗ рекомендует ограничить применение лактобактерий, образующих левовращающую D(-) форму молочной кислоты, в пищевых продуктах для взрослых и избегать — для новорожденных. Среди бактерий, относящихся к таковым, и Lactobacillus acidophilus . В то же время правовращающая L(+) форма молочной кислоты должна входить в состав пищевого рациона новорожденных. Это обусловлено тем, что L(+) молочная кислота полностью и быстро метаболизируется. Наличие же неметаболизированной молочной кислоты приводит к метаболическому ацидозу, особенно у новорожденных и лиц пожилого возраста (рис. 4).
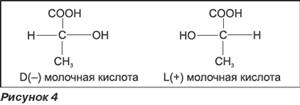
L(+) молочная кислота более активно участвует в следующих процессах:
a) улучшение усвоения молочного протеина;
б) улучшение усвоения кальция, фосфора и железа;
в) стимуляция выделения желудочного сока;
г) ускорение движения содержимого желудка;
д) является источником энергии в процессе дыхания.
Среди лактобактерий, образующих правовращающую L(+) форму молочной кислоты, наиболее часто используется L.sporogenes , которая также называется Bacillus coagulans . L.sporogenes впервые была изолирована и описана в 1933 г. Л.М. Горовиц-Власовой и Н.В. Новотельновым. Этот тип лактобактерий образует споры, которые при активации в кислотной среде желудка прорастают в двенадцатиперстной кишке, эффективно предупреждая рост патогенных организмов. Медленное выделение живых клеток приводит к пролонгированной, эффективной и полезной микробной деятельности. Споры L.sporogenes медленно выводятся из организма человека через продолжительное время после окончания курса терапии.
Насколько доступны лекарственные препараты, содержащие лактобактерии, в нашей стране? В настоящее время зарегистрировано менее 10 (о пищевых добавках речь не идет) таких препаратов, содержащих разные виды лактобактерий. Причем в большинстве из них лактобактерии сочетаются с другими видами микроорганизмов (к сожалению, не всегда соответствующими требованиям ВОЗ к штамму пробиотиков).
В нашей стране пока зарегистрирован единственный препарат, содержащий L.sporogenes , — Лактовит форте. Он содержит 120 млн спор лактобактерий L.sporogenes , которые прекрасно сохраняются в период приготовления и хранения, являются термостойкими и в отличие от L.acidophilus устойчивыми к лиофилизации. Благодаря спорообразованию L.sporogenes выживают в кислой среде желудочного содержимого, а также в присутствии антибиотиков и желчи в двенадцатиперстной кишке. L.sporogenes , содержащиеся в препарате Лактовит форте, медленно выводятся из организма — на протяжении 10-12 дней после прекращения приема. Лактовит форте препятствует росту патогенных микроорганизмов и способствует стимуляции роста собственной лактофлоры.
Дополнительное содержание витаминов В 12 и В 9 обусловливает репаративный эффект в отношении слизистой оболочки ЖКТ, а также терапию анемии, часто встречающейся при инфекционных процессах. Присутствие фолиевой кислоты усиливает гипохолестеринемический эффект лактобактерий.
Назначается препарат Лактовит форте по 1-2 капсулы 2 раза в день за 40 минут до еды. Применение Лактовита форте у пациентов различных возрастных групп подтвердило клиническую эффективность и безопасность препарата.
Таким образом, назначение пробиотика на основе спор лактобацилл Лактовит форте вполне обоснованно рассматривают как эффективный метод восстановления состава и функций физиологического микробиоценоза человека.
Список литературы
1. Бережной В.В., Крамарев С.А., Шунько Е.Е. Микрофлора человека и роль современных пробиотиков в ее регуляции // Здоровье женщины. — 2004. — № 1 (17).— С. 134-139.
2. Блудова Н.Г. Лактобактерии, пробиотики и иммунная система кишечника // Сучасна гастроентерологія. — 2005. — № 4. — С. 115-120.
3. Коршунов В.М., Володин Н.Н., Агафонова С.А. и др. Влияние пробиотиков и биотерапевтических препаратов на иммунную систему организма хозяина // Педиатрия. — 2002. — № 5. — С. 92-100.
4. Шатихин А.И., Литвицкий П.Ф., Сурнакова Н.Е. и др. Влияние факторов среды на состояние системы иммунобиологического надзора // Аллергология и иммунология. — 2004. — Т. 5, № 2. — С. 285-288.
5. Дранік Г.Н. Клінічна імунологія та алергологія: Навчальний посібник. — Одеса: Астропринт, 1999. — 604 c.
6. Воробьев А.А., Несвижский Ю.В., Липницкий Е.М. и др. Исследование пристеночной микрофлоры желудочно-кишечного тракта у человека в норме и при патологии // Вестн. РАМН. — 2004. — № 2.— С. 43-47.
7. Теслюк Л.В. Клініко-імунологічна характеристика хворих на ревматоїдний та реактивний артрити при наявності пілоричного хелікобактеріозу та дисбактеріозу кишечника: Автореф. дис... канд. мед. наук. — К., 2000. — 20 c.
8. Alvarez S., Herrero C., Bru E. et al. Effect of Lactobacillus casei and yogurt administration on prevention of Pseudomonas aeruginosa infection in young mice // J. Food Prot. — 2001. — Vol. 64, № 11. — P. 1768-1774.
9. Boirvirant M., Pica R., De Maria R. et al. Stimulated human lamina propria T cells manifest enhanced Fas-mediated apoptosis // J. Clin. Invest. — 1996. — Vol. 98. — P. 2616-2622.
10. Delneste Y., Donnet-Hughes A., Schiffrin E.J. Mechanisms of Action on Immunocompetent Cells // Nutr. Rev. — 1998. — Vol. 56. — P. 93-98.
11. Gill H.S., Rutherford K.J. Viability and dose response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice // Br. J. Nutr. — 2001. — Vol. 86, № 2. — P. 285-289.
12. Gill H.S., Rutherford K.J., Cross M.L. et al. Enhancement of immunity in the elderly by dietary supplementation with probiotic Bifidobacterium lactis HN019 // Am. J. Clin. Nutr. — 2001. — Vol. 74, № 6. — P. 833-839.
13. Gill H.S., Rutherford K.J., Prasad J. et al. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019) // Br. J. Nutr. — 2000. — Vol. 83, № 2. — P. 167-176.
14. Herias M.V., Hessle C., Telemo E. et al. Immunomodulatory effects of Lactobacillus plantarum colonising the intestine of gnotobiotic rats // Food Res. Int. — 1999. — Vol. 116. — P. 283-290.
15. Hori T., Kiyoshima J., Shida K. et al. Augmentation of cellular immunity and reduction of influenza virus titer in aged mice fed Lactobacillus casei strain Shirota // Clin. Diagn. Lab. Immunol. — 2002. — Vol. 9. — P. 105-108.
16. Jiang H.Q., Bos N.A., Cebra J.J. Timing, localization and persistence of colonisation by segmented filamentous bacteria in the neonatal mouse gut depend on immune status of mothers and pups // Infect. Immun. — 2001. — Vol. 69. — P. 3611-3617.
17. Lu L., Walker W.A. Pathologic and physiologic interactions of bacteria with the gastrointestinal epithelium // Am. J. Clin. Nutr. — 2001. — 73 (Suppl.). — P. 1124S-30S.
18. Perdigon G., Alvarez S. Probiotics and the immune state // Probiotics. Chapman and Hall / Ed. by R. Fuller. — London, 2003. — Р. 146-176.
19. Perdigon G., Vintini E., Alvarez S. et al. Study of the possible mechanisms involved in the mucosal immune system activation by lactic acid bacteria // J. Dairy Sci. — 1999. — Vol. 82. — P. 1108-1114.
20. Pessi T., Sutas Y., Marttinen A. et al. Probiotics reinforce mucosal degradation of antigens in rats: Implications for therapeutic use of probiotics // Am. Soc. Nutr. Sci. — 2001. — P. 2313-2318.
21. Savage D.C. Mucosal microbiota // Mucosal Immunology / Ed. by P.L. Ogra, J. Mestecky, M.E. Lamm, W. Strober, J.R. McGhee, J. Bienestock. — San Diego: Academic Press, 2000. — P. 216-238.
22. Sheih Y.H., Chiang B.L., Wang L.H. et al. Systemic immunity-enchanting effects in healthy subjects following dietary consumption of the lactic acid bacterium Lactobacillus rhamnosus (HN001) // J. Am. Coll. Nutr. — 2001. — Vol. 20, № 2 (Suppl.). — P. 149-156.
23. Stebbins C.E., Galan J.E. Structural mimicry in bacterial virulence // Nature. — 2001. — Vol. 412. — P. 701-705.
24. Tejada, Simon M.V., Ustunol Z. et al. Effects of lactic acid bacteria ingestion of basal cytokine mRNA and immunoglobulin levels in the mouse // J. Food Protect. — 1999. — Vol. 62. — P. 287-291.
25. Vitini E., Alvarez S., Medina M. et al. Gut mucosal immunostimulation by lactic acid bacteria // Biocell. — 2000. — Vol. 24, № 3. — P. 223-232.
26. Uhlig H.H., Mottet C., Powrie F. Homing of intestinal immune cells // Novartis Found. Symp. — 2004. — Vol. 263. — P. 179-188.
27. Von der Weid T., Bulliard C., Schifirm E.J. Induction by a lactic acid bacterium of a population of CD4+ T-cells with low proliferative capacity that produce transforming growth factor beta and interleukin // Clin. Diagn. Lab. Immunol. — 2001. — Vol. 8, № 4. — P. 695-701.
Очень часто многие женщины начинают обращать внимание, что интимные выделения изменили свои свойства: стали более обильными, появился неприятный запах. Кроме того, могут возникать ощущения во влагалище неприятного характера в виде зуда, жжения. Многие женщины также могут столкнуться с проблемами в половой сфере. Казалось бы, что может объединить данные проявления? Причиной может стать бактериальный вагиноз, или другое название данного заболевания: синдром дефицита лактобактерий.
Во влагалище женщины живут и размножаются различные микроорганизмы, и в норме самую большую часть составляют именно лактобактерии. Они вырабатывают различные активные вещества, которые защищают организм женщины от каких-либо воспалительных процессов. В частности таким веществом является перекись водорода, поэтому кислотность содержимого влагалища составляет 3,6-4,5 и вредные микробы просто «не выживают».
Однако в силу различных причин количество лактобактерий снижается, что приводит к росту количества других микроорганизмов, которые не только не защищают, но и вредят организму женщины, что приводит к развитию данного заболевания.
Опасен ли бактериальный вагиноз?
В результате снижения количества лактобактерий «вредные» микроорганизмы начинают проникать «все выше, и выше», достигая шейки матки и даже самой матки. Все это приводит к серьёзным последствиям: невынашиванию беременности, изменениям шейки матки (вплоть до онкологических), бесплодию, острому воспалению матки - эндометриту.
В том случае, если заболевание диагностировано у беременной женщины и не проведено необходимое лечение, то исход зависит от срока беременности. На раннем сроке (до 16 недель) – возможен выкидыш (самопроизвольное прерывание беременности), на сроке более 22 недель – велика вероятность преждевременных родов. Если же заболевание возникло непосредственно перед родами, то высок риск воспалительных процессов, как у матери, так и у новорожденного уже в послеродовом и, соответсвенно, в неонатальном периоде.
Провоцирующие факторы
Приём гормональных препаратов
Прием антибактериальных препаратов, гормонов, антидепрессантов;
Использование внутриматочного контрацептива (спираль, диафрагма и др.) на длительный срок;
Частое использование тампонов на длительное время;
Нарушение менструального цикла;
Возрастные изменения организма (менопауза);
Изменения после родов, аборта;
Травматическое повреждение половых органов;
Нарушение личной гигиены половых органов;
Стрессовые ситуации.
Бактериальный вагиноз не относится к группе заболеваний, передающихся при половом контакте. Однако сексуальное поведение имеет важное значение в развитии данного заболевания. Начало половой жизни в возрасте 14-15 лет, ее особенности, число половых партнеров – все это факторы риска по развитию синдрома дефицита лактобактерий. Особо хочется отметить, что именно число половых партнеров является более значимым в развитии заболевания, нежели число половых контактов.
Симптомы синдрома дефицита лактобактерий
Основным проявлением бактериального вагиноза является значительное количество выделений из половых путей беловатого или сероватого цвета с неприятным запахом (классически описывают схожесть с запахом «тухлой рыбы»), которые могут усиливаться или появляться после полового акта.
Также провокатором данного стояния могут явиться и менструации. Существовать такие выделения могут годами. С течением времени они несколько меняют свои свойства: становятся более густыми, пенящимися, липкими, приобретают желтоватую окраску. Зуд, жжение во влагалище, проблемы в половой сфере - все это может сопутствовать при бактериальном вагинозе.
Диагностика бактериального вагиноза
 Бактериальный вагиноз, по современным данным, является одним из самых часто встречаемых заболеваний среди половозрелых женщин. Поэтому, если у Вы подозреваете у себя симптомы бактериального вагиноза, (зуд, жжение, неприятный запах интимных выделений и др.) необходимо в срочном порядке обратиться к акушер - гинекологу. Кроме того, все беременные в обязательном порядке при первом обращении в женскую консультацию, в каждом триместре, и перед родами проходят обследование на выявление данного заболевания.
Бактериальный вагиноз, по современным данным, является одним из самых часто встречаемых заболеваний среди половозрелых женщин. Поэтому, если у Вы подозреваете у себя симптомы бактериального вагиноза, (зуд, жжение, неприятный запах интимных выделений и др.) необходимо в срочном порядке обратиться к акушер - гинекологу. Кроме того, все беременные в обязательном порядке при первом обращении в женскую консультацию, в каждом триместре, и перед родами проходят обследование на выявление данного заболевания.
Важной особенностью является то, что при бактериальном вагинозе у многих женщин выявляют еще и доброкачественные новообразования шейки матки (эктопия, эктропион, полипы и др.). Поэтому при лечении бактериального вагиноза было бы отлично «проверить» шейку матки.
Для диагностики данного заболевания современные ученые разработали специальные тест-полоски - «Кольпо-тест рН». Принцип их действия основан на определение кислотности содержимого влагалища. Используя данные полоски, женщина может самостоятельно в домашних условиях проверить, больна ли она бактериальном вагинозом. Кроме того, цена данного теста достаточно демократичная.
Лечение
В лечении главными задачами являются: уничтожить возросшее число «вредных» микробов с помощью антибактериальных препаратов, а также увеличить число лактобактерий, то есть восстановить микрофлору влагалища. Существует множество схем лечения, которые различаются по длительности приема, спектра воздействия на микроорганизмы, способа применения.
Хотелось бы отметить, что лучше отдать предпочтение местных препаратам (свечи, гель, спринцевание), поскольку они «встречаются» с микробами напрямую. При этом не идет воздействия на все органы и системы женщины, а побочных эффектов меньше. Данный вариант особо приемлем в случае бактериального вагиноза у беременной женщины. Приведем одни из наиболее эффективных антибактериальных препаратов:
- клиндамицин во влагалище 100 (1 свеча) в течение 3 суток, либо;
- клиндамицин крем 2%-5 г на ночь в течение 6 суток, либо;
- метронидазол во влагалище 1 свеча 2 раза в сутки, либо;
- метронидазол в виде геля 0,75%-5,0 г на ночь; продолжительность – 5 суток.
Однако в настоящее время врачи все чаще склоняются к назначению нового препарата тиберала.
Преимущество такого препарата являются незначительное количество побочных эффектов, совместимость с алкоголем, а также отсутствие резистентности микроорганизмов к тибералу.
Небеременным женщинам назначают тиберал по 500 мг в сутки в течение 5 дней, беременным женщинам (только 2 и 3 триместрах) по 1,5 г внутрь 1 раз.
При беременности также необходимо к антибактериальным препаратам добавить противогрибковые препараты, так как сама по себе беременность – это состояние сниженного иммунитета. Поэтому весьма вероятен рост грибковой флоры влагалища. Предпочтительней использование клотримазола по 100 мг (по 1 вагинальной таблетке) на ночь в течение 6-7 суток, либо натамицина по 100 мг (1 свеча) на ночь в течение 3-6 суток.
 Для нормализации микрофлоры влагалища, восстановление популяции лактобактерий после окончания курса антибактериальных препаратов назначают бифидобактерии бифидум, либо лактобактерии ацидофильные во влагалище по 1 свече на ночь, продолжительность курса 10 дней.
Для нормализации микрофлоры влагалища, восстановление популяции лактобактерий после окончания курса антибактериальных препаратов назначают бифидобактерии бифидум, либо лактобактерии ацидофильные во влагалище по 1 свече на ночь, продолжительность курса 10 дней.
Так как бактериальный вагиноз развивается на фоне сниженного иммунитета, весьма эффективно после курса антибактериальных препаратов, принимать иммунную терапию. Лучшими в этой сфере являются: женьшеня экстракт по 20-25 капель 2 раза в день в течение 1 месяца. Весьма популярен среди акушеров-гинекологов элеутерококка корневища и корни экстракт по 20 капель 3 раза в день в течение месяца.
Важно отметить, что если у вашего полового партнера имеются признаки воспалительного процесса в мочевом пузыре или другом органе (цистит, уретрит и др.), необходимо провести соответствующее обследование, и при необходимости, лечение, так как в данной ситуации это может служить причиной повторного заболевания - рецидива.
Фото препаратов, рекомендованных для лечения бактериального вагиноза